Гипоксия лечение. Симптомы и лечение у ребенка лечение гипоксии
Строго говоря, гипоксия — это не диагноз. Так называется состояние, когда организм по тем или иным причинам не получает необходимого для полноценного функционирования количества кислорода. Она может возникать не только у новорожденных, но и у людей взрослого возраста, различны лишь причины, из-за которых возникает кислородное голодание. Следствием гипоксии является нарушение работы жизненно важных органов вплоть до необратимых изменений. Наиболее опасно это состояние для центральной нервной системы. Именно головной мозг получает 20 % всего поступающего в кровь кислорода, поэтому гипоксия может обусловить возникновение неврологических заболеваний.
При возникновении гипоксии симптомы и лечение (если оно вообще требуется) зависят от степени кислородного голодания.
Симптомы гипоксии у детей определяются еще при родах. Сразу после появления ребенка медперсонал оценивает его состояние по шкале Апгар. При этом по 10-балльной системе оценивается состояние кожных покровов, рефлекторной возбудимости и тонуса мышц.
Различают три степени гипоксии:
- 8–10 баллов — означает отличное состояние новорожденного;
- 7–6 баллов — гипоксия первой степени, считающаяся легкой формой;
- 5–4 баллов — гипоксия второй степени, классифицируемая как средняя форма;
- 3–0 баллов — третья степень гипоксии, тяжелая форма.
Кислородное голодание легкой степени обычно не сказывается на дальнейшем развитии ребенка, ее симптомы проходят очень быстро. Такая гипоксия лечения не требует.
Гипоксия 2-й степени при должном уходе и лечении редко становится причиной нарушений нормальной работы организма. В первые месяцы лечения возможны нарушения нормального режима сна, тревожность, тремор подбородка.
Тяжелая степень гипоксии может вызвать серьезные последствия в организме ребенка — нередки судороги, задержки в развитии, различные нарушения работы головного мозга.
Если лечение ребенка, перенесшего гипоксию, не начать вовремя, то возможны различные физические и умственные нарушения в развитии. Часто последствиями гипоксии являются гипертонус, задержки психоречевого развития, аутизм, ДЦП, в редких случаях вероятен летальный исход.
Избежать всего этого можно, если еще в раннем возрасте начать лечение последствий гипоксии. Вот почему при выявлении диагноза «гипоксия» у ребенка лечение нужно начинать как можно раньше. В медицинском центре «Клиника Мельниковой Е.А» проводится полная диагностика раннего выявления нарушений работы головного мозга, после которой высококвалифицированные специалисты дадут все рекомендации для родственников и индивидуально подберут курс лечения. Головной мозг ребёнка очень чувствителен к гипоксическому повреждению, но в то же время очень пластичен, т. е. от природы наделен восстановительными и компенсаторными функциями. Поэтому лечение гипоксии и ее последствий по методикам, разработанным главврачом нашей Клиники — врачом-невропатологом высшей категории Мельниковой Е.А. — дает наилучшие положительные результаты при своевременном обращении.
Восстановление детей после гипоксии в центре ДокторНейро
Гипоксия у новорожденных – это очень часто встречающийся термин в педиатрической практике. Простыми словами, он обозначает нехватку малышу кислорода во время беременности или в родах.
Причины гипоксии у новорожденных
Причины для этого могут быть самые разнообразные: различные заболевания мамы, резус-конфликт, преждевременное старение плаценты, обвитие пуповины, курение, неблагоприятная экология. При таком разнообразии причин, не удивительно, что гипоксия новорожденного встречается у огромного количества малышей, особенно в крупных городах. Лечение гипоксии начинается непосредственно в роддоме и зависит от ее степени выраженности (о выраженном состоянии можно говорить при выставлении оценки по шкале Апгар 6 и менее баллов), длительности нехватки кислорода, а также того, какие системы пострадали в наибольшей степени./baby-preemie-92465521-5958091b3df78c4eb6558f63.jpg)
Наблюдение
Стоит помнить о том, что компенсаторные возможности новорожденных очень велики, а уровень развития современной медицины высок, поэтому чаще всего с серьезными последствиями гипоксии можно справиться. Однако это не отменяет отдаленных последствий в виде повышенной возбудимости, утомляемости, гиперактивности, нарушений внимания, задержки речевого развития, дизартрии, нарушений формирования школьных навыков и много другого. Поэтому начиная с раннего возраста и до момента начала школьного обучения (а лучше и в начальных классах школы) детям с последствиями гипоксии новорожденных стоит наблюдаться врачами и специалистами психолого-педагогического профиля с целью предотвращения или своевременной коррекции особенностей в развитии.
Лечение
Специалисты нашего центра: неврологи, логопеды, дефектологи, психологи, нейропсихологи, нейрореабилитологи – помогут вам оценить развитие вашего ребенка, предоставят информацию о его трудностях и компенсаторных возможностях, составят индивидуальную программу комплексного сопровождения, проведут курс занятий при необходимости.
Гипоксия у новорожденных и детей старшего возраста
Гипоксия у новорожденных и детей старшего возраста
Гипоксия (или кислородное голодание) — довольно частая патология, которая встречается у детей всех возрастов и особенно у новорожденных.
У новорожденных, гипоксия зачастую спровоцирована заболеваниями матери, которые влияют на внутриутробное развитие ребенка и затрудняющих процесс родов. В их число входят проблемы с кровеносной системой, сердечная недостаточность, неправильный образ жизни – курение, алкоголь, прием запрещенных при беременности препаратов, – и многое другое. Если к гипоксии ребенка, возникшей от заболеваний матери, присоединяется еще и патологические роды, то степень гипоксии может увеличиваться во много раз.
В данной статье мы будем рассматривать начальные проявления недостаточности кровоснабжения мозга.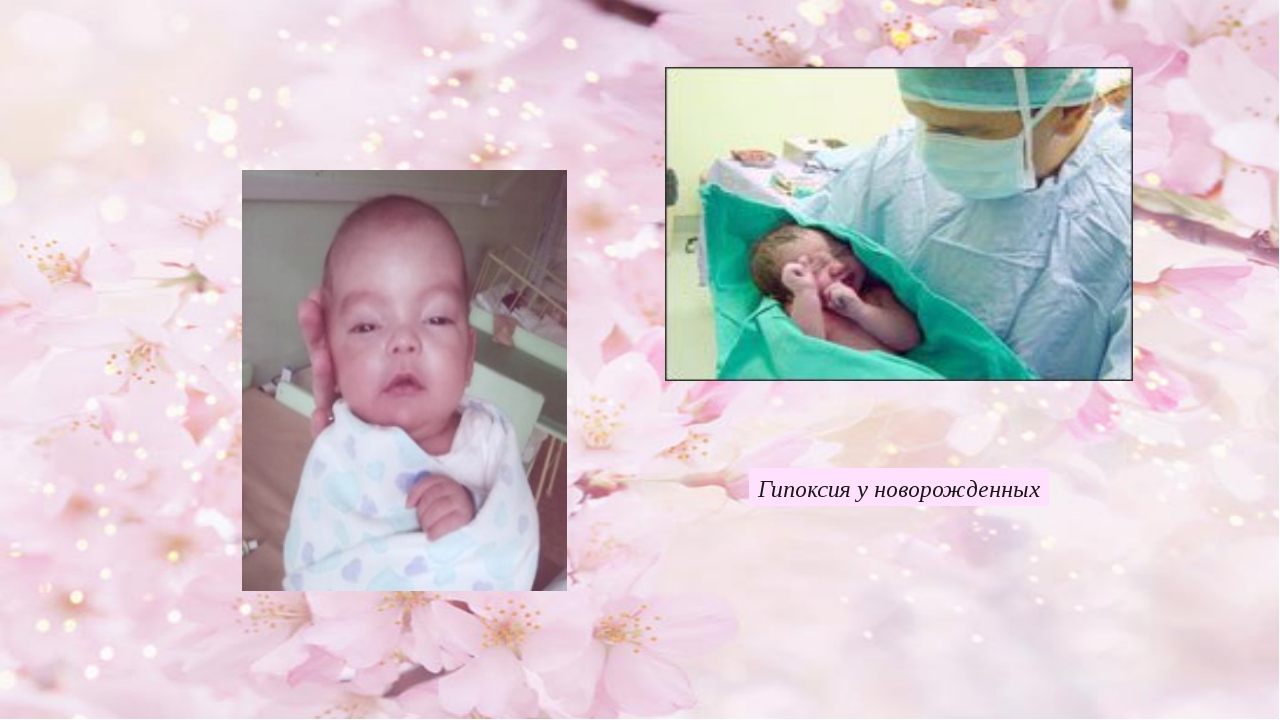
Повреждение шейного отдела позвоночника, перинатальная энцефалопатия, асфиксия и другие диагнозы могут быть выставлены ребенку сразу после родов, которые и будут являться распространенными причинами развития гипоксии головного мозга. Родители чаще всего приходят к детскому неврологу или другому узкому специалисту, когда нервная система ребенка получает повышенную нагрузку – диагноз ставится непосредственно перед школой или в первом классе. Причем, по оценке специалистов, число таких детей сегодня составляет 70-80%. Самыми частыми жалобами родителей является:
- эмоциональная лабильность своего ребенка и метеозависимость;
- высокая нервная возбудимость;
- нарушения речевой функции различной степени;
- трудности с обучаемостью и концентрированием внимания;
- плохое поведение;
- головные боли и головокружения;
- нарушение зрения и т.д.
Несмотря на то, что очень часто гипоксию головного мозга в результате сосудистых нарушений диагностируется очень часто у школьников, ее первые симптомы можно заметить на первом году жизни ребенка. Такие дети буквально с первых дней отличаются повышенной возбудимостью, у них присутствуют нарушения сна и аппетита, повышенный тонус мышц, угнетение безусловных рефлексов.
Основной и самой частой причиной появления гипоксии у детей является родовая травма. Стремительные роды, стимуляция родовой деятельности, кесарево сечение являются пусковым механизмом для ослабления той или иной функции детского организма, в результате чего появляются симптомы характерные для сосудистых нарушений. Во время движения по родовым путям шейный отдел ребенка испытывает огромные нагрузки, что может вызвать смещение шейных позвонков и привести к нарушению кровоснабжения головного мозга.
Не менее распространено и опасно сдавливание, деформация и повреждение костей черепа. Все это напрямую отражается на оболочках головного мозга и на кровообращении и снабжении его кислородом.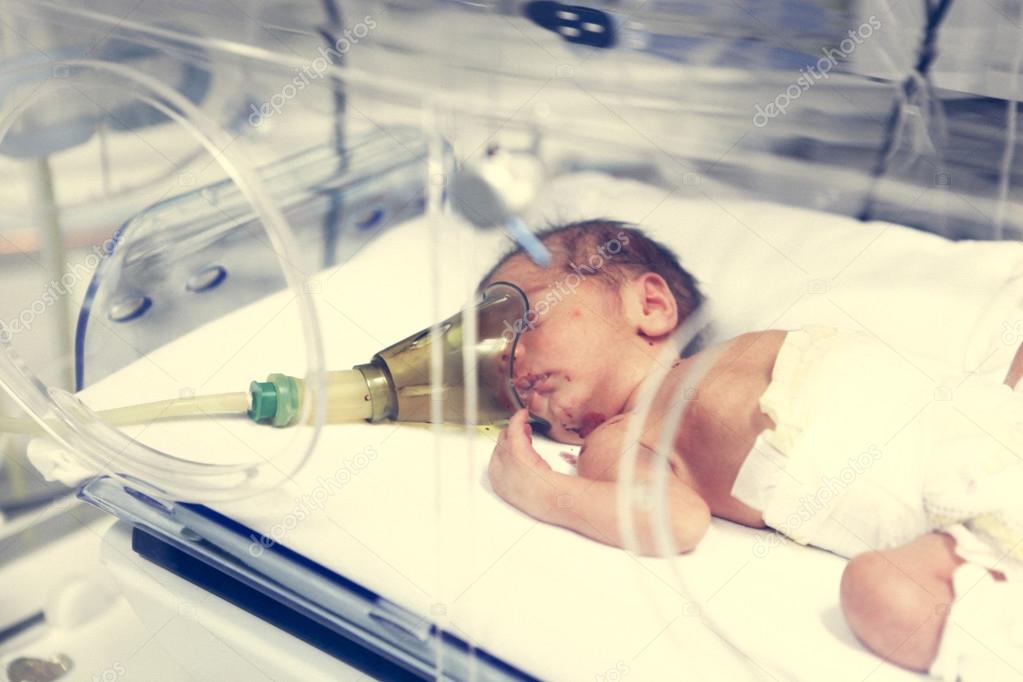
Нервная система вместе с мышечной, костной, системой кровообращения и другими системами является частью единого целого организма и нарушения или изменения функции и структуры в одной из них всегда вызывает сбой в других. Поэтому сосудистые нарушения головного мзга – это всегда комплекс нарушений и симптомов, характеризующийся индивидуальностью для каждого ребенка. И если некоторые из этих проявлений есть у вашего ребенка, желательно не откладывать визит к специалистам.
Лечение ребенка с гипоксией всегда должно быть комплексным: главное в процессе лечения сосудистых нарушений – благоприятная атмосфера в семье, режим и коррекционные мероприятия, способствующие выздоровлению малыша, наблюдение у невропатолога, логопеда, ортопеда и других специалистов. В лечении гипоксии хорошо зарекомендовала себя остеопатия, так как остеопат в ходе коррекции рассматривает организм ребенка в качестве целостной системы.
Ошибочно считать, что остеопат вылечит от всех болезней и навсегда избавит вашего ребенка от всех адаптационных симптомов сосудистых нарушений головного мозга, сделает его хорошим учеником и успешным человеком в жизни. Остеопатия лишь вносит некоторые изменения, воздействуя на сосудистую и нервную систему, систему кровообращения ребенка и другие системы. Так как самая частая причина гипоксии – травматическое повреждение, спровоцировавшее нарушение кровообращение головного мозга, остеопат должен найти основной источник проблемы и восстановить эти процессы при помощи мягких техник. Остеопатическая коррекция оказывается особенно эффективной в тех случаях, когда причина нарушения кроется в смещении позвонков, блоке швов свода и основания черепной коробки или травмах шейного отдела позвоночного столба. Ведь именно от правильного расположения мозговых оболочек, костей черепа и позвонков и возможности свободных микродвижений, зависит кровоснабжение головного мозга.

Желательно, чтобы остеопатическое лечение сочеталось с комплексом других лечебных и профилактических мероприятий, включающих лечебную физкультуру, постоянные занятия и упражнения с ребенком, работой по его воспитанию и т.д. Например, при нарушении кровообращения речевых участков головного мозга, ребенок может неправильно произносить слова или буквы. При остеопатическом лечении, восстановление кровоснабжения данных участков, улучшит состояние поврежденных нейронных связей, а речевой аппарат ребенка будет иметь больше возможностей приспособиться к новым условиям организма. Этот момент будет самым плодотворным, если с ребенком заниматься, прививая ему правильное произношение. В результате регулярных занятий он научится грамотно говорить и мыслить уже без посторонней помощи. Те же самые процессы мы можем наблюдать и при нарушениях в физическом развитии, психологическом состоянии и т.д.
Очевидно, что никакими лекарственными средствами механические последствия травмы устранить невозможно. В арсенале остеопата большое множество мягких мануальных техник, с помощью которых можно устранить первопричину и тем самым убрать препятствия для хорошего кровообращения и тока ликвора. А организм дальше начнёт работать сам, т.к. запустится процесс самовосстановления.
Остеопатические сеансы для детей с сосудистыми нарушениями головного мозга назначаются обычно раз в неделю и длятся не более 30-60 мин. Длительность терапевтического курса подбирается в каждом случае индивидуально. Как правило, уже после четырех-пяти сеансов удается нормализовать состояние пациента и создать условия, необходимые для правильного развития его организма. Поэтому, если для родителей важно не упустить чтобы легкая гипоксия головного мозга их ребенка перешли в более тяжелые формы, желательно при наличии любых отклонениях, показаться специалисту.
ПОЛУЧИТЕ БЕСПЛАТНУЮ КОНСУЛЬТАЦИЮ ПО ТЕЛЕФОНУ
+ 7 (495) 114-14-95
Гипоксия победима!
Сегодня половине (!) беременных женщин, проживающих в крупных городах, гинекологи ставят диагноз «гипоксия плода»./GettyImages-586039908-59a49d52aad52b00114bbfc1.jpg) Мы привыкли считать знакомое нестрашным. Если же потратить 15 минут на самообразование в проблеме гипоксии, можно понять:
Мы привыкли считать знакомое нестрашным. Если же потратить 15 минут на самообразование в проблеме гипоксии, можно понять:
1) насколько она опасна,
2) ее можно избежать,
3) недуги ребенка, рожденного даже в тяжелой степени гипоксии, поддаются лечению (все зависит от усердия родителей).
О проблеме гипоксии нас консультирует заведующая отделением патологи беременности роддома N7 Ирина Хабировна Байрамова.
КАК ВОЗНИКАЕТ ГИПОКСИЯ
Кислород и питательные вещества поступают к плоду через маточно-плацентарный кровоток. При нарушениях этого кровотока плод получает недостаточно питательных веществ и кислорода. Этот недостаток и называют гипоксией.
Гипоксия всегда является результатом плацентарной недостаточности (нарушения функций и раннего старения плаценты). Поэтому поиск причин гипоксии — в причинах плацентарной недостаточности. А их немало:
— Инфекционные заболевания, особенно протекающие в острой форме или обостряющиеся во время беременности. В особой группе риска — женщины, не пролечившие до беременности инфекции, передающиеся половым путем.
— Различные хронические заболевания, имеющиеся у беременной (заболевания сердечнососудистой системы, почек, печени, легких).
— Гормональные нарушения в организме беременной.
— Иммунологические проблемы (например, иммунологический конфликт между мужем и женой).
Совет по избежанию этой группы причин — обследоваться до наступления беременности и пролечивать все свои недуги, дабы они не повлияли на здоровье будущего малыша. Если не получилось до беременности — в крайнем случае, в первом триместре.
— Угроза прерывания беременности тоже вызывает гипоксию плода. Это состояние характеризуется повышенным сокращением мускулатуры матки, а это опять же вызывает ухудшение кровотока в матке и плаценте, и, следовательно, ограничивает приток кислорода и питательных веществ к плоду.
— Гестоз — коварное осложнение беременности, при котором питательные вещества и кислород проходят «мимо» плода (выводятся выделительной системой женщины). Даже легкий гестоз, незаметный внешне в виде отеков на теле беременной, вызывает отек плаценты и, как следствие, гипоксию.
Совет: если врач ставит вам эти диагнозы и предлагает лечение в стационаре, не отказывайтесь. Не думайте, что отеки или тянущие боли внизу живота — это только «ваши» проблемы. Данные патологии неизбежно ведут к гипоксии плода, которая обуславливает различные пороки его развития.
Для большей убедительности напомним, что в хронической форме гипоксия оказывает влияние на отклонения в развитии плода, в острой — на его жизнь. Острая форма гипоксии, вызванная повышенным тонусом матки, проявляется как одномоментный спазм сосудов маточно-плацентарного кровотока, при котором доступ кислорода к плоду прерывается. Без немедленного оказания медицинской помощи жизнь плода — под угрозой. Острая форма гипоксии, вызванная тяжелым гестозом, проявляется как отслойка плаценты. Жизнь плода в этом случае может спасти только экстренное родоразрешение.
КАК ПРОЯВЛЯЕТСЯ ГИПОКСИЯ У НОВОРОЖДЕННОГО
В первые минуты жизни новорожденного неонатолог оценивает пять показателей его жизнеспособности по шкале Апгар:
— сердцебиение
— дыхание
— цвет кожных покров
— мышечный тонус
— наличие врожденных рефлексов
За каждый показатель в норме выставляется по 2 балла. Малыш на 9-10 баллов полностью здоров: розовенький, мышцы в тонусе (ручки и ножки прижаты к животу, голова — к груди, есть сосательный и хватательный рефлексы, крик громкий, свидетельствующий о нормальном запуске дыхательной системы, сердечный тон четкий, ясный. 8 баллов свидетельствуют о легкой степени гипоксии плода (может наблюдаться, например, незначительная синюшность кожных покровов). О средней степени гипоксии говорят, когда ребенок рождается с немного синенькими ладошками, стопами, лицом, ручки в суставах слегка разогнуты, сосет ребенок слабо, кричит тоже слабо (6 баллов). Тяжелая степень гипоксии проявляется в том, что кожные покровы новорожденного бледные, ручки и ножки разогнуты, крика нет, сосание очень слабое или отсутствует, сердцебиение есть (4 балла).
Тяжелая степень гипоксии проявляется в том, что кожные покровы новорожденного бледные, ручки и ножки разогнуты, крика нет, сосание очень слабое или отсутствует, сердцебиение есть (4 балла).
ПОСЛЕДСТВИЯ ГИПОКСИИ
Доказано, что наиболее кислородозависимыми являются нервные клетки, поэтому от гипоксии в первую очередь страдает центральная нервная система плода. В зависимости от степени гипоксии неврологические нарушения новорожденного варьируются от функциональных (обратимых) расстройств (например, пониженный мышечный тонус, снижение активности врожденных рефлексов) до тяжелых нарушений психического развития.
Интересно, что организм плода обладает огромными компенсаторными способностями, поэтому при первых проявлениях гипоксии организм малыша начинает работать в усиленном режиме, перераспределяя кислородные потоки на критически важные для жизни органы и системы: головной мозг, сердце, надпочечники. Естественно, при этом лишаются своей «нормальной порции» кислорода и питательных веществ другие органы — легкие, почки, желудочно-кишечный тракт, кожные покровы. В них-то и могут возникнуть патологии развития в том случае, если организм плода справляется с задачей спасения от пороков развития центральной нервной системы. Однако возможности компенсаторных механизмов имеют предел, и при длительной гипоксии эта защита ослабевает.
У детей, рожденных со средней или тяжелой степенью гипоксии в период новорожденности могут наблюдаться следующие нарушения развития:
- гипотрофия (недостаточный вес),
- снижение мышечного тонуса и угнетение физиологических рефлексов (сосание, хватание),
- синдром дыхательных расстройств,
- аномалии развития — дисплазия тазобедренных суставов, кривошея, пороки сердца и др.
В будущем при отсутствии лечения дети, страдавшие гипоксией в период внутриутробного развития, могут испытывать:
- задержку развития физических и психических навыков,
- повышенное внутричерепное давление,
- частые ОРВИ и кишечные расстройства,
- синдром повышенной возбудимости.

Любые состояния гипоксии, зафиксированные на момент рождения ребенка, лечатся, — успокаивает Ирина Хабировна Байрамова. — Если в течение первого года жизни ребенка приложить все усилия для устранения последствий гипоксии, то к году ваш малыш не будет отличаться по психофизическому развитию от своих сверстников. Последствия легкой гипоксии хорошо лечатся с помощью массажей и упражнений для отдельных групп мышц. Особенно хорошо помогают упражнения в воде, поскольку они стимулируют психо-эмоциональную сферу ребенка, восстанавливая тем самым поврежденные в результате гипоксии участки мозга. Более тяжелые формы гипоксии лечат непосредственно в роддоме медикаментозными методами. Даже при хороших результатах лечения родителям важно знать, что теперь их ребенку особенно важно регулярно наблюдаться у врачей разных специальностей, главными из которых являются педиатр и невролог. Они будут осуществлять контроль за развитием психического здоровья малыша, исключать поздние проявления пороков развития нервной системы.
ПОБЕДИТЬ ГИПОКСИЮ
Еще лучше лечить гипоксию плода внутриутробно, чтобы предотвратить знакомство с описанными выше неприятными диагнозами у своего малыша.
Диагноз «гипоксия плода» ваш акушер-гинеколог может поставить не ранее 28 недели беременности. Он делает это, выслушивая сердцебиение плода стетоскопом. Нормальное сердцебиение плода — 120-160 ударов в минуту. Если оно больше или меньше, можно подозревать о наличии гипоксии. Чтобы сказать наверняка, врачу необходимы результаты исследований КТГ (электрокардиограмма плода), УЗИ (смотрится степень зрелости плаценты и качество околоплодных вод). В некоторых случаях для уточнения диагноза необходимо проведение допплеровского исследования (показывает наличие или отсутствие проблем сосудистого кровотока в матке и плаценте).
Если данные исследования указывают на наличие средней и тяжелой степени гипоксии, беременной обязательно нужно ложиться в стационар. Без уточняющих вопросов «А обязательно ли это?». » Я рекомендую полежать в стационаре и пройти курс лечения даже беременным с легкой гипоксией плода, — говорит Ирина Хабировна Байрамова. — Для преодоления легкой гипоксии, как правило, достаточно просто отдохнуть от забот и перестать нервничать. Но обычно этот совет гинеколога женщины либо игнорируют, либо у них просто нет возможности дома устроить себе полноценный отдых. Прибрать, приготовить, помыть, а еще есть старший ребенок, муж… Планы «полежать отдохнуть вечерком» как правило, срываются…
Без уточняющих вопросов «А обязательно ли это?». » Я рекомендую полежать в стационаре и пройти курс лечения даже беременным с легкой гипоксией плода, — говорит Ирина Хабировна Байрамова. — Для преодоления легкой гипоксии, как правило, достаточно просто отдохнуть от забот и перестать нервничать. Но обычно этот совет гинеколога женщины либо игнорируют, либо у них просто нет возможности дома устроить себе полноценный отдых. Прибрать, приготовить, помыть, а еще есть старший ребенок, муж… Планы «полежать отдохнуть вечерком» как правило, срываются…
При лечении гипоксии в условиях стационара проводится терапия, направленная на улучшение снабжения плода кислородом и нормализацию процесса обмена веществ. Если у пациентки с тяжелой гипоксией плода не наблюдается улучшений в течение трех дней, это может свидетельствовать о наличии необратимых изменений в системе «мать-дитя» (например, об отслойке плаценты), и врачи могут принять решение о досрочном родоразрешении на любом сроке беременности (напомним, диагноз «гипоксия» ставится не ранее 28 недели) с целью сохранения жизни ребенка.
— Здоровье большинства женщин, к сожалению, сегодня далеко не идеально, — констатирует Ирина Хабировна Б.айрамова. — Различные хронические заболевания, стрессы, усталость, чрезмерная нагрузка на работе провоцируют различные осложнения беременности. В результате диагноз «плацентарная недостаточность» ставят сегодня каждой второй беременной женщине, «угроза прерывания беременности» — каждой третьей. А если есть плацентарная недостаточность или повышенный тонус матки, значит, есть гипоксия плода. Этот диагноз встречается у 50-70% беременных женщин. Но это не означает, что можно успокоиться тем, что «у всех сейчас так». Ни в коем случае! Напоминания врачей о том, что беременной женщине нужны достаточный сон, отдых, прогулки на свежем воздухе не менее трех часов в день, хорошее питание и витамины, противопоказаны физические, умственные и эмоциональные перегрузки — не пустые слова! Даже имея отклонения в собственном здоровье, женщина может выносить здорового ребенка, если будет придерживаться этих советов. И еще — обследоваться до наступления беременности, чтобы подлечить свои хронические заболевания, исключить или пролечить заболевания, передающиеся половым путем. Крутясь, как белка в колесе в бешеном темпе нашей жизни, остановитесь на секунду и подумайте, что вам важнее — ваша работа (к которой вы еще успеете вернуться, когда малыш подрастет), чистота в доме (к которой можно попробовать относиться проще) или здоровье будущего ребенка? Ведь здоровый или практически здоровый малыш — это огромная экономия жизненных сил, денег и счастье для любой семьи. А девять месяцев — не такой долгий отрезок времени, на который можно попытаться снизить свои нагрузки на любимой работе (например, воспользоваться правом нашего законодательства о сокращении рабочего дня беременной женщины на один час), переложить на кого-нибудь часть забот по дому (или просто забыть о них!) и освоить новое увлечение — медитацию, которое позволит вам расслабляться и успокаиваться, когда эмоции зашкаливают.
И еще — обследоваться до наступления беременности, чтобы подлечить свои хронические заболевания, исключить или пролечить заболевания, передающиеся половым путем. Крутясь, как белка в колесе в бешеном темпе нашей жизни, остановитесь на секунду и подумайте, что вам важнее — ваша работа (к которой вы еще успеете вернуться, когда малыш подрастет), чистота в доме (к которой можно попробовать относиться проще) или здоровье будущего ребенка? Ведь здоровый или практически здоровый малыш — это огромная экономия жизненных сил, денег и счастье для любой семьи. А девять месяцев — не такой долгий отрезок времени, на который можно попытаться снизить свои нагрузки на любимой работе (например, воспользоваться правом нашего законодательства о сокращении рабочего дня беременной женщины на один час), переложить на кого-нибудь часть забот по дому (или просто забыть о них!) и освоить новое увлечение — медитацию, которое позволит вам расслабляться и успокаиваться, когда эмоции зашкаливают.
Александра Медведева
Влияние хронической внутриутробной гипоксии на постнатальную адаптацию у новорожденных и методы коррекции Текст научной статьи по специальности «Клиническая медицина»
Е.Г. Цой
Кемеровская государственная медицинская академия, кафедра факультетской педиатрии,
г. Кемерово
ВЛИЯНИЕ ХРОНИЧЕСКОЙ ВНУТРИУТРОБНОЙ ГИПОКСИИ НА ПОСТНАТАЛЬНУЮ АДАПТАЦИЮ У НОВОРОЖДЕННЫХ И МЕТОДЫ КОРРЕКЦИИ
Гипоксия плода — патологическое состояние, возникающее у плода при недостаточном снабжении кислородом его тканей и органов или неадекватной утилизации ими кислорода. Перинатальная гипоксия остается основной причиной повреждений ЦНС плода и новорожденного, что, в свою очередь, приводит к нарушению соматического и нервно-психического развития детей. Установлено, что выраженность этих патологических изменений зависит от длительности и тяжести внутриутробной гипоксии плода [18, 32]. Кроме того, гипоксия является одним из основных факторов формирования детской церебральной патологии [29]. Это, прежде всего, формирование задержки развития двигательных функций, затем задержка решения познавательных и глазодвигательных задач, что в последующем становится основой трудностей обучения, особенно чтению и письму, нарушения поведения, социальной и профессиональной адаптации.
Кроме того, гипоксия является одним из основных факторов формирования детской церебральной патологии [29]. Это, прежде всего, формирование задержки развития двигательных функций, затем задержка решения познавательных и глазодвигательных задач, что в последующем становится основой трудностей обучения, особенно чтению и письму, нарушения поведения, социальной и профессиональной адаптации.
Внутриутробная гипоксия или гипоксия плода рассматривается как первичная патология [23, 29]. В свою очередь, она может быть антенатальной, т.е. иметь место до начала родовой деятельности, и инт-ранатальной, когда кислородная недостаточность плода возникает в период родового акта, а также перинатальной. Внутриутробная гипоксия обусловлена двумя основными причинами: недостаточность фетоплацентарного комплекса и болезнь самого плода [29], выделяют еще 3-ю группу этиологических факторов — заболевания беременной, сопровождающиеся гипоксией и гипоксемией [23, 31].
По длительности различают хроническую внутриутробную гипоксию плода (ХВГ), которая охватывает период от нескольких дней до нескольких недель, и острую, которая продолжается от нескольких минут до нескольких часов и обычно развивается в родах [23, 29].
Газообмен плода зависит от следующих факторов: содержание кислорода и углекислого газа в
крови матери, состояние маточного, маточно-пла-центарного и фетоплацентарного кровотоков, состояние кровообращения самого плода. Недостаточность любого из этих факторов или нескольких из них вызывает ряд компенсаторно-приспособительных реакций, важнейшими из которых являются повышение скорости плацентарного кровотока, гиперплазия плаценты, возрастание емкости капиллярного русла фетальной зоны плаценты и ускорение кровотока плода [31]. Недостаточность фетоплацентарного комплекса является ведущей причиной как острой, так и хронической внутриутробной гипоксии плода.
Различают первичную и вторичную фетоплацен-тарную недостаточность. К первичной фетоплацен-тарной недостаточности приводят аномалии развития плаценты, в т.ч. аномальное ее прикрепление, отслойка плаценты, воспалительные и иные болезни плаценты, петрификация, аномалия и патология пуповины. Возникает она до 16-й недели гестации, в период имплантации, раннего эибриогенеза и плацентации [37]. К вторичной фетоплацентарной недостаточности приводят токсикозы беременности (ОПГ-гестозы), экстрагенитальные заболевания матери, особенно сахарный диабет и заболевания сердечно сосудистой системы, нефропатии на фоне уже сформированной плаценты, после 16-й недели гестации [31].
Кислородная недостаточность является отправным фактором патогенеза ХВГ и острой гипоксии плода. Дальнейшее развитие патологического процесса определяется временным фактором. При ХВГ кислородная недостаточность, как правило, умеренная, но сохраняется длительно, что позволяет плоду постепенно приспосабливаться к изменяющимся условиям существования. В первую очередь, отмечается усиление процессов тканевого дыхания и повышение анаэробного гликолиза, что приводит к потере из клеток так называемой возбуждающей аминокислоты — глутамата, а также
ВЛИЯНИЕ ХРОНИЧЕСКОЙ ВНУТРИУТРОБНОЙ ГИПОКСИИ I НА ПОСТНАТАЛЬНУЮ АДАПТАЦИЮ У НОВОРОЖДЕННЫХ И МЕТОДЫ КОРРЕКЦИИ |
других аминокислот — глицина, янтарной и др. [44, 23]. Кроме того, наблюдается активация зрит-ропоэза, приводящая к возрастанию числа эритроцитов в крови (эритроцитоз) и увеличению вязкости крови [36].
Наконец, в ответ на гипоксию отмечается активация функциональной активности надпочечников, повышение выработки и экскреции их гормонов, что приводит к перераспределению крови по типу централизации кровообращения. Повышение вязкости крови и ее перераспределение существенно изменяют микрогемодинамику. Происходит замедление кровотока в капиллярном русле паренхиматозных органов, сладжирование форменных элементов крови, их секвестрация с локальным, местным повышением свертывающего потенциала крови и развитием локального микротромбообра-зования [29]. Это, в свою очередь, усугубляет газообмен в тканях, усиливает гипоксию, нарушает васкуляризацию паренхиматозных органов, создает ситуацию их микроциркуляторной блокады, с последующим нарушением функции.
Повышение вязкости крови и ее перераспределение существенно изменяют микрогемодинамику. Происходит замедление кровотока в капиллярном русле паренхиматозных органов, сладжирование форменных элементов крови, их секвестрация с локальным, местным повышением свертывающего потенциала крови и развитием локального микротромбообра-зования [29]. Это, в свою очередь, усугубляет газообмен в тканях, усиливает гипоксию, нарушает васкуляризацию паренхиматозных органов, создает ситуацию их микроциркуляторной блокады, с последующим нарушением функции.
В первую очередь, патологические изменения разворачиваются в веществе головного мозга, где наиболее слабо выражены механизмы анаэробного гликолиза и поэтому гипоксия развивается раньше и интенсивнее [29, 36]. Нарушение дыхательного метаболизма клеток паренхиматозных органов и, прежде всего, клеток мозга обуславливает переход ионов натрия и молекул воды внутрь клеток в обмен на потерю клетками ионов калия. Происходит открытие медленных кальциевых каналов, снижается выход свободного кальция из эндоплазмати-ческого ретикулума. Ослабление активности кальциевого насоса вызывает аномальное, избыточное накопление ионов кальция в клетках ЦНС. Это, в свою очередь, приводит к ряду патологических сдвигов. В частности, отмечается повышение активности протеаз, липаз, протеинкиназы С в клетках, усиливаются процессы свободнорадикального окисления, повышается концентрация токсичного син-клетного иона кислорода. Эти метаболиты оказывают непосредственное разрушающее воздействие на компоненты клеток, приводя к их гибели — некрозу [3, 39, 40].
Другим важным механизмом, лежащим в основе нарушений электрогенеза нервной ткани, служит расстройство метаболизма нейротрансмитте-ров, которое возникает уже при незначительном недостатке кислорода. При гипоксии показано нарушение синтеза ацетилхолина, дофамина, норад-реналина и серотонина [22]. Острый и отдаленный эффекты гипоксии различны. Известно, что немедленный эффект заключается в подавлении продукции норадреналина и противоречивом, иногда меняющемся по минутам, уровне синтеза дофамина. Отдаленный эффект заключается в селективном повышении синтеза норадреналина в среднем мозге и повышении синтеза дофамина. Наряду с этим доказано, что антенатальная гипоксия вызывает задержку врастания холинергических и серотонинер-
Известно, что немедленный эффект заключается в подавлении продукции норадреналина и противоречивом, иногда меняющемся по минутам, уровне синтеза дофамина. Отдаленный эффект заключается в селективном повышении синтеза норадреналина в среднем мозге и повышении синтеза дофамина. Наряду с этим доказано, что антенатальная гипоксия вызывает задержку врастания холинергических и серотонинер-
гических волокон в гипокамп и кору головного мозга, и увеличивает дегенерацию серотонинергичес-ких аксонов по мере эволюции организма. Нарушение формирования и ветвления холинергических и серотонинергических волокон является одной из причин не только неонатальной гипоксически-ише-мической энцефалопатии (НГИЭ), но и дальнейших поведенческих расстройств (возможно, синдрома дефицита внимания) [42].
Гемодинамические и метаболические изменения при ХВГ на тканевом уровне вызывают два основных повреждения: геморрагический инфаркт вследствие микроциркуляторной блокады, местной активации процессов свертывания крови с микротромбообразованием и развитием (местно) потребления факторов свертывания и потребления тромбоцитов, и развитие ишемии (лейкомаляции) вещества мозга и других паренхиматозных органов. Геморрагическому и ишемическому поражению вещества мозга (особенно геморрагическому) способствуют колебания артериального давления в сосудах мозга и, прежде всего, его падение при снижении сердечного выброса, острой сосудистой недостаточности или снижении объема циркулирующей крови [2, 9, 16, 29].
При развитии плода в неблагоприятных антенатальных условиях, у матерей уменьшено содержание адаптивных гормонов и энергетических субстратов, выражен смешанный респираторно-метаболический ацидоз. Это обуславливает снижение компенсаторно-защитной функции материнского организма в интересах плода и приводит к необычно ранней, еще до его рождения, активизации компенсаторно-защитных механизмов детского организма. Одним из следствий раннего включения нейроэндокринных механизмов защиты в организме плода, развивающегося в условиях хронической гипоксии, является изменение неспецифической реактивности детского организма. Развитие дистресса и срыв адаптации у детей данной группы особенно часто возникают на 2-3 сутки, на высоте фазы суперкомпесации, когда особенно высоки требования к функциональным и энергетическим ресурсам организма [10].
Одним из следствий раннего включения нейроэндокринных механизмов защиты в организме плода, развивающегося в условиях хронической гипоксии, является изменение неспецифической реактивности детского организма. Развитие дистресса и срыв адаптации у детей данной группы особенно часто возникают на 2-3 сутки, на высоте фазы суперкомпесации, когда особенно высоки требования к функциональным и энергетическим ресурсам организма [10].
Изучая в течение многих лет этиологию и патогенез заболеваний нервной системы у детей, исследователи единодушно пришли к выводу, что большая часть из них обусловлена гипоксически-ише-мическими повреждениями мозга в перинатальном периоде [4, 18, 43]. Многие авторы отмечают, что более половины всех расстройств функций ЦНС у детей раннего возраста обусловлены не острой гипоксией в родах, а длительной, хронической гипоксией плода и новорожденного. Акцентируя основное внимание на структурных повреждениях мозга, приводящих к летальности, выраженным психоневрологическим расстройствам или инвалидности с детства, большинство авторов как бы игнорировали значительную группу детей с функциональными нарушениями нервной системы. По сравнению с тяжелыми формами церебральных
■ ВЛИЯНИЕ ХРОНИЧЕСКОЙ ВНУТРИУТРОБНОЙ ГИПОКСИИ НА ПОСТНАТАЛЬНУЮ АДАПТАЦИЮ У НОВОРОЖДЕННЫХ И МЕТОДЫ КОРРЕКЦИИ
расстройств, они казались настолько незначительными, что их коррекция чаще всего предоставлялась самой природе. Однако известная и широко распространенная формула «с возрастом все пройдет» не оправдала себя. Именно с возрастом эти, казалось бы, незначительные расстройства усиливались, приводя к нарушениям малой локомоции, развития речи, изменениям поведения и трудностям обучения [5].
Безусловно, довольно высокие показатели по шкале Апгар, 6-8 баллов, свидетельствуют о достаточно благополучном состоянии здоровья новорожденного, о сравнительно не тяжелом кислородном дефиците.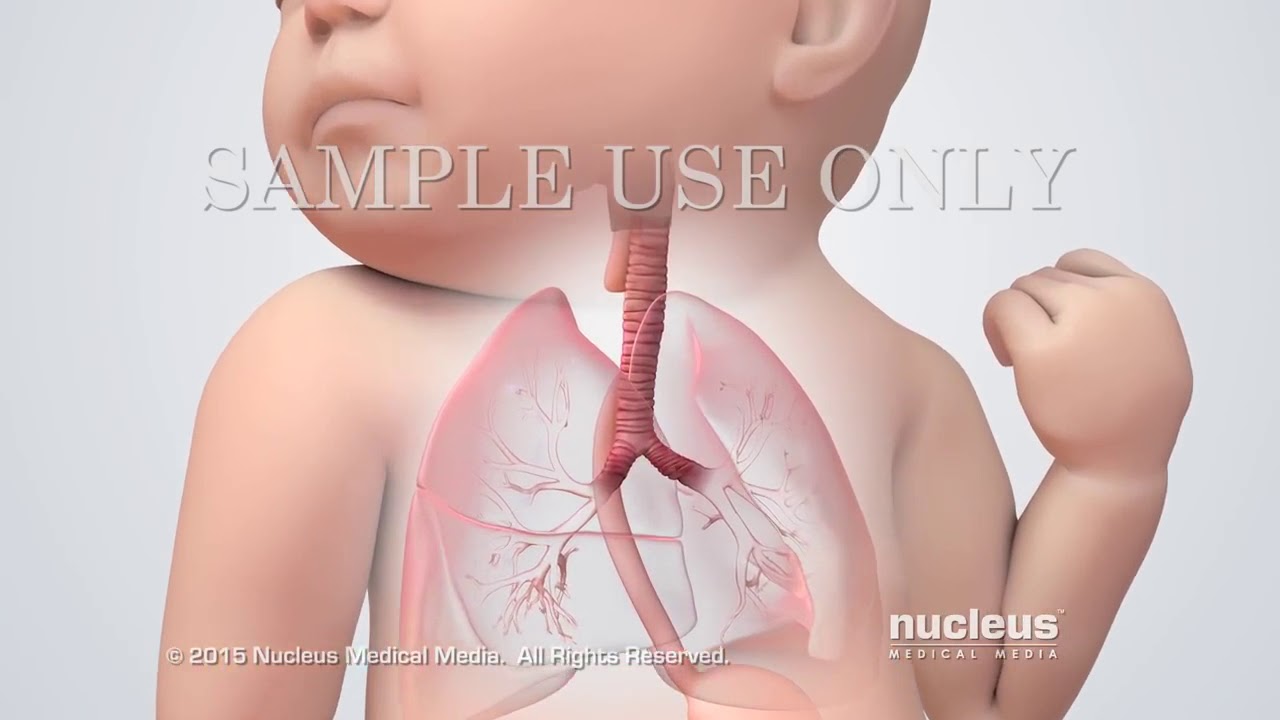 Однако они практически не отражают тот ущерб, который наносит временной фактор длительного кислородного голодания. Об этом с большей степенью достоверности можно судить по характеру метаболических и регулятор-ных сдвигов, морфологической и функциональной зрелости организма плода и новорожденного. Но именно эта сторона часто остается за пределами внимания исследователей и врачей, и может становиться причиной как неблагополучной адаптации новорожденного к внеутробному существованию, так и длительных изменений функции ЦНС ребенка, и, в конечном счете, нарушению его развития [30].
Однако они практически не отражают тот ущерб, который наносит временной фактор длительного кислородного голодания. Об этом с большей степенью достоверности можно судить по характеру метаболических и регулятор-ных сдвигов, морфологической и функциональной зрелости организма плода и новорожденного. Но именно эта сторона часто остается за пределами внимания исследователей и врачей, и может становиться причиной как неблагополучной адаптации новорожденного к внеутробному существованию, так и длительных изменений функции ЦНС ребенка, и, в конечном счете, нарушению его развития [30].
Легкие степени гипоксии плода и новорожденного, по мнению ряда авторов, прогностически более неблагоприятны, чем средняя степень тяжести. Это объясняется, по-видимому, отсутствием реабилитационной терапии при легких формах сразу после рождения [34]. Новорожденные, перенесшие ХВГ легкой степени, не могут рассматриваться как здоровые дети, несмотря на сравнительно высокую оценку состояния их здоровья при рождении, так как они, по-видимому, склонны к дизадаптацион-ным процессам. У этих детей выявляются признаки морфофункциональной незрелости, период ранней неонатальной адаптации характеризуется рядом особенностей, сближающих их с недоношенными новорожденными, в 6 раз чаще встречаются неврологические расстройства [30].
Функциональные нарушения перинатального генеза могут манифестировать в различные сроки, их декомпенсация происходит лишь по мере возрастания предъявляемых требований к тем или иным нервно-психическим функциям в процессе развития [5, 34]. Хроническая внутриутробная гипоксия ведет к развитию разнообразной палитры последствий поражения ЦНС — от незначительных дизгенезий, не проявляющихся клинически, до грубых аномалий развития нервной системы. Существуют противоречивые мнения по поводу влияния хронической внутриутробной гипоксии на возможности последующего психомоторного развития ребенка, особенности формирования ранних и поздних неврологических нарушений, способности ребенка компенсировать перенесенное поражение ЦНС [12]. Большинство исследователей считают, что характер и степень выраженности неврологичес-
Большинство исследователей считают, что характер и степень выраженности неврологичес-
ких последствий не зависит от типа неврологических симптомов, наблюдаемых у ребенка в раннем неонатальном периоде. Легкая степень поражения ЦНС вследствие хронической фетоплацентарной недостаточности приводит не только к формированию функциональных изменений со стороны мозга, но и к структурным морфологическим изменениям, требующим довольно интенсивной и длительной терапии и реабилитации [30].
Хроническая внутриутробная гипоксия плода, связанная с заболеваниями матери, отягощенным акушерско-гинекологическим анамнезом, инфекционным поражением и другими причинами, приводит к незрелости и нарушениям адаптивных процессов во внутренних органах еще во время беременности [7]. Возникая под влиянием гипоксии, эти нарушения сохраняются в течение длительного времени после рождения. Воздействие неблагоприятных факторов в перинатальном периоде рассматривается как предпосылка к замедленному и асинхронному созреванию сердечно-сосудистой системы, что способствует нарушению морфогенеза, функции проводящей системы сердца и вегетативной нервной системы, обуславливая формирование ряда аритмий в постнатальном периоде [6].
Согласно общепринятым представлениям [21, 22, 24], нарушения ритма могут встречаться как в остром периоде перинатального поражения нервной системы, так и в качестве поздних, отсроченных осложнений. Одной из возможных причин развития нарушений ритма у детей служит нарушение регулирующего влияния центральной и периферической нервной системы на ритм сердца. Вегетативную дизрегуляцию считают возможным инициирующим фактором кардиального механизма синдрома внезапной младенческой смерти [8]. По данным ряда авторов, возможной причиной подобных расстройств является повреждение регуля-торных центров ствола головного мозга в результате перенесенной гипоксии [41].
Перинатальную острую и хроническую гипоксию обозначают патогенетически значимым фактором развития аритмий у новорожденных. Авторы отмечают преобладание тахизависимых форм в сочетании с нарушениями процессов реполяризации в структуре нарушений ритма, а также существенное повышение тонуса симпатического отдела вегетативной нервной системы. Сохраняющийся в течение первых месяцев жизни дисбаланс симпатических и парасимпатических влияний на сердце является одним из аритмогенных факторов [6, 20, 33]. Хроническая гипоксия плода, не приводящая к клинически значимой патологии у доношенных новорожденных, влияет на течение адаптационного процесса, способствуя снижению эффективности и укорочению периода компенсации, удлинению периода спада функциональной активности с нарастанием симпатикотонии, что выявляется при помощи кардиоинтервалографии (КИГ) [35].
Наличие гипоксического компонента предполагают в генезе развития электрической нестабиль-
ности миокарда у детей 2-4 месяцев, снижения сократительной способности миокарда, изменения морфофункционального состояния сердца, нарушения диастолической функции миокарда [13, 15, 25]. Снижение функциональных возможностей сократительного миокарда у новорожденных задерживает реализацию неонатальной перестройки внутрисердечной и общей гемодинамики. Существенное значение в организме новорожденного имеет снижение общего кровотока, которое негативно сказывается на питании поврежденных отделов ЦНС и восстановлении их функциональной активности [26, 27, 28].
Таким образом, многими исследователями получены данные, свидетельствующие о длительном нарушении процессов адаптации у детей, перенесших внутриутробную гипоксию. Ранняя диагностика подобных пограничных состояний позволит, путем своевременной их коррекции, предупредить возможное в дальнейшем развитие заболеваний.
Имеются данные, свидетельствующие о том, что антиоксидантные препараты (витамин Е и карнити-на хлорид), применяемые в комплексной терапии новорожденных с выраженными клиническими проявлениями ХВГ, оказывают положительное влияние, способствуют обратному развитию патологических симптомов, улучшают восстановление первоначальной массы тела, снижают частоту развития и выраженность физиологической желтухи. Наряду с нормализацией клинических параметров, под влиянием антиоксидантов в сыворотке крови новорожденных на протяжении всего раннего нео-натального периода происходит повышение содержания Fe, Си, и Se [11]. Применение витамина Е в раннем неонатальном периоде у новорожденных, перенесших ХВГ, способствует нарастанию парасимпатических влияний на сердечный ритм, нормализации частотных областей вариабельности сердечного ритма. Эти изменения способствуют увеличению компенсаторных возможностей организма [35].
Антенатальное введение а-токоферола является весьма эффективным и приближается по своему действию к постнатальному применению данного препарата. Это проявляется меньшей физиологической потерей в массе тела (анаболический эффект), относительно быстрой нормализацией неврологического статуса (мембраностабилизирую-щий, антигипоксический эффекты), ранним отпадением остатка пуповины и заживлением пупочной ранки, меньшей частотой инфекционных заболеваний, возможно, вследсвие иммуностимулирующего действия [17].
Сочетание неврологических и кардиальных нарушений при перинатальной гипоксии известно давно, и рассматривается как цереброкардиаль-ный синдром, что и послужило патогенетическим обоснованием для назначения нейрометаболитной терапии [1]. Полученные данные об определяющем влиянии изменений ЦНС на развитие аритмий позволили сделать акцент на нейротропные
препараты в проводимой терапии. С целью улучшения метаболических и гемодинамических нарушений, назначались антигипоксанты, витамины, кардиопротекторы, сосудистые препараты и дезаг-реганты. Положительный эффект был получен без назначения антиаритмических препаратов [33].
С целью улучшения метаболических и гемодинамических нарушений, назначались антигипоксанты, витамины, кардиопротекторы, сосудистые препараты и дезаг-реганты. Положительный эффект был получен без назначения антиаритмических препаратов [33].
Метаболитные препараты — коферментные формы витаминов группы В (кокарбоксилаза, рибофлавина мононуклеотид, пиридоксальфосфат и липоевая кислота) — способствуют улучшению клеточной адаптации, что позволяет рекомендовать включение этих препаратов в комплексную реабилитацию детей, перенесших гипоксию [38].
Лечение гипоксических поражений головного мозга является полем жарких дискуссий и крайних мнений, от полного отказа применения нейротроп-ных препаратов (подобная точка зрения преобладает в ряде зарубежных клиник) до избыточной и агрессивной терапии — такие схемы лечения приняты в некоторых медицинских учреждениях России [22]. Лечение гипоксически-ишемической энцефалопатии включает в себя мероприятия, направленные на основные механизмы патогенеза церебральных нарушений и коррекцию самих церебральных нарушений. Прежде всего, проводится лечение гипоксии: восстановление проходимости дыхательных путей и адекватная вентиляция легких в режиме создания гипокапнии без гиперокси-емии; ликвидация гиповолемии; поддержание адекватной перфузии мозга путем профилактики системной гипо- и гипертензии, полицитемии, повышенной вязкости, гиперволемии; охранительный режим; систематическая доставка к мозгу энергии в виде глюкозы; коррекция метаболических нарушений (ацидоз, гипогликемия, гипокаль-циемия, гипомагнезиемия и т.д.).
Следующий этап — лечение отека головного мозга и нейронопротекция. В качестве нейроноп-ротекторов используют витамин Е (осуществляет блокаду свободных радикалов), кортикостероиды (способны механически встраиваться в структуру мембраны из-за морфологического сходства со структурными элементами мембраны, осуществляют блокаду свободных радикалов), барбитураты (блокируют свободные радикалы и каналы С1-), аллопуринол (наряду со снижением уровня мочевой кислоты и повышением уровня серотонина, блокирует свободные радикалы). В качестве ноот-ропного препарата в лечении гипоксически-ише-мической энцефалопатии целесообразен пираце-там, применяемый с раннего неонатального периода [22].
В качестве ноот-ропного препарата в лечении гипоксически-ише-мической энцефалопатии целесообразен пираце-там, применяемый с раннего неонатального периода [22].
Коррекцию постгипоксической ишемии миокарда, сопровождающейся сниженной контрактильной и насосной функцией миокарда, и ее ранних последствий у новорожденных предлагается проводить в два этапа: в раннем неонатальном периоде — ци-томак и трентал, в последующие недели периода новорожденности — рибоксин [25, 27].
До настоящего времени подходы к выбору и оценке эффективности фармакотерапии неинвазив-
■ ВЛИЯНИЕ ХРОНИЧЕСКОЙ ВНУТРИУТРОБНОЙ ГИПОКСИИ НА ПОСТНАТАЛЬНУЮ АДАПТАЦИЮ У НОВОРОЖДЕННЫХ И МЕТОДЫ КОРРЕКЦИИ
ными объективными методами четко не разработаны. Возможность использования КИГ для обоснования лекарственного воздействия, подбора дозы и оценки эффективности очевидна [18, 35]. Благодаря тому, что посредством КИГ легко выявляется напряжение адаптационных механизмов, метод, в принципе, пригоден для оценки состояния дезадаптации при любой патологии на стадии предболезни либо в период выхода из нее. Учет такого состояния делает возможным своевременное использование средств из арсенала профилактической и восстановительной фармакологии. С помощью КИГ вероятна маркировка временной организации целого организма, необходимая для реализации хроно-фармакологических задач.
ЛИТЕРАТУРА:
1. Акжамалов, С.И. Цереброкардиальный синдром у детей раннего возраста (дифференциальная диагностика) /С.И. Акжамалов, В.В. Белопасов //Рос. вест. перинат. и пед. — 1998. — № 5. -С. 26-29.
2. Александрова, Н.К. Допплерографическая оценка нарушений мозгового кровотока у новорожденных детей в раннем неона-тальном периоде /Н. К. Александрова: Автореф. дис. … канд. мед. наук. — Москва, 1993. — 24 с.
К. Александрова: Автореф. дис. … канд. мед. наук. — Москва, 1993. — 24 с.
3. Барашнев, Ю.И. Перинатальная неврология /Ю.И. Барашнев. -М., 2001. — 640 с.
4. Барашнев, Ю.И. Перинатальная патология новорожденных /Ю.И. Барашнев, А.Г. Антонов, Н.И. Кудашов. //Акуш. и гин. —
1994. — № 4. — С. 26-31.
5. Барашнев, Ю.И. К генезу минимальных мозговых дисфункций у детей /Ю.И. Барашнев, А.Э. Лицев. //Рос. вест. перинат. и пед. —
1995. — № 6. — С. 11-17.
6. Бокерия, Е.Л. Нарушения ритма сердца у новорожденных детей при гипоксически-ишемической энцефалопатии /Е.Л. Бокерия. //Рос. вест. перинат. и пед. — 2001. — № 1. — С. 19-21.
7. Воронцов, И.М. Синдром внезапной смерти детей 1-го года жизни; биологическая зрелость и пограничные состояния /И.М. Воронцов, И.А. Кельмансон. //Педиатрия. — 1990. — № 1. — С. 84-90.
8. Воронцов, И.М. Синдром внезапной смерти грудных детей /И.М. Воронцов, И.А. Кельмансон А.В. Цинзерлинг. — СПб., 1997. — 220 с.
9. Гаврюшов, В.В. Церебральная гемодинамика и теплопродукция мозга у недоношенных детей. Церебральная ишемия /В.В. Гав-рюшов, М.С. Ефимов, И.Ю. Галкина. //Ультразвук. диагн. в акуш., гинек. и пед. — 1994. — № 3. — С. 80-89.
10. Дементьева, Г.М. Профилактика нарушений адаптации и болезней новорожденных: Лекция для врачей /Г.М. Дементьева, Ю.Е. Вельтищев. — М., 1998. — 39 с.
11. Дещекина, М.Ф. Влияние антиоксидантов на содержание биоэлементов в сыворотке крови новорожденных, перенесших хроническую внутриутробную гипоксию /М. Ф. Дещекина, В.Ф. Демин, С.О. Ключников. //Педиатрия. — 1990. — № 6. — С. 69-72.
Ф. Дещекина, В.Ф. Демин, С.О. Ключников. //Педиатрия. — 1990. — № 6. — С. 69-72.
12. Ильенко, Л.И. Катамнестическое наблюдение за детьми, перенесшими перинатальную патологию ЦНС /Л.И. Ильенко, Г.С. Голос-ная, А.С. Петрухин. //Педиатрия. — 1996. — № 5. — С. 46-50.
13. Козлова, Л.В. Нарушение адаптации сердечно-сосудистой системы у детей после перинатальной гипоксии /Л.В. Козлова, О.А. Короид. //Рос. пед. журн. — 1999. — № 3. — С. 11-14.
14. Коломенская, А.Н. Лечебная педагогика в реабилитации новорожденных высокого неврологического риска в амбулаторных
условиях /А.Н. Коломенская, Н.К. Александрова. //Матер. 2 съ. РАСПМ «Перинатальная неврология». — М., 1997. — С. 98-99.
15. Кравцова, Л.А. Сравнительный анализ влияний гипоксии на характеристики ЭКГ у детей первых месяцев жизни и экспериментальных животных /Л.А. Кравцова, М.А. Школьникова, П.В. Ба-лан. //Вест. аритмологии. — 2000. — № 18. — С. 45-48.
16. Кудашов, Н.И. Мозговой кровоток у новорожденных с асфиксией /Н.И. Кудашов, Н.В. Иванова. //Вопр. охр. мат. и дет. — 1992. -№ 1. — С. 20-23.
17. Кукушкина, И.П. Оценка влияния витамина Е на организм плода и новорожденного /И.П. Кукушкина, Н.В. Дмитриева. //Педиатрия. — 1991. — № 5. — С. 13-16.
18. Кулаков, В.И. Перинатальная патология: истоки и пути снижения /В.И. Кулаков, Ю.И. Барашнев. // Акуш. и гинекол. — 1994. -№ 6. — С. 3-7.
19. Кулаков В.И., Червакова Т.В., Болдин И.А., Тохиян А.А. //Акуш. и гинекол. — 1996. — № 1. — С. 54-56.
20. Лукина, Л. И. Кардиоваскулярные заболевания у новорожденных /Лукина Л.И., Котлукова Н.П., Чернявская Н.А. //В кн. «Актуальные вопросы кардиологии детского возраста» /Под ред. Ю.М. Бе-лозерова. — М., 1997. — С. 16-24.
И. Кардиоваскулярные заболевания у новорожденных /Лукина Л.И., Котлукова Н.П., Чернявская Н.А. //В кн. «Актуальные вопросы кардиологии детского возраста» /Под ред. Ю.М. Бе-лозерова. — М., 1997. — С. 16-24.
21. Михалев, Е.В. Структура сердечного ритма и клинические аспекты адаптации недоношенных новорожденных с гипокси-чески-травматическим поражением ЦНС на этапах реабилитации /Е.В. Михалев: Автореф. дис. … канд. мед. наук. — Томск,
1997. — 22 с.
22. Пальчик, А.Б. Гипоксически-ишемическая энцефалопатия новорожденных /Пальчик А.Б., Шабалов Н.П. — СПб., 2000. — 219 с.
23. Первичная и реанимационная помощь новорожденным: Практ. руков. /Г.М. Дементьева, А.С. Колонтаев, В.С. Малышев и др. /Под ред. А.Д. Царегородцева, Г.М. Дементьевой. — М., 1999. -80 с.
24. Попова, И.А. Состояние сердечно-сосудистой системы у детей с перинатальным поражением нервной системы /И.А. Попова: Автореф. дис. … канд. мед. наук. — М., 1991. — 23 с.
25. Прахов, А.В. Коррекция транзиторной постгипоксической ишемии миокарда у новорожденных /А.В. Прахов. //Педиатрия. —
1998. — № 5. — С. 38-42.
26. Прахов, А.В. Электрокардиографические критерии тяжести тран-зиторной ишемии миокарда у новорожденных /А.В. Прахов. //Педиатрия. — 1997. — № 5. — С. 54-58.
27. Прахов, А.В. Эффективность внутривенного введения цитомака при синдроме транзиторной ишемии миокарда у новорожденных /А.В. Прахов. //Рос. вест. перинат. и пед. — 1995. — № 2. -С. 17-19.
28. Прахов, А.В. Клинико-электрокардиографические особенности транзиторной ишемии миокарда у новорожденных, перенесших гипоксию /А. В. Прахов, Е.В. Мурашко. //Педиатрия. -1996. — № 1. — С. 38-41.
В. Прахов, Е.В. Мурашко. //Педиатрия. -1996. — № 1. — С. 38-41.
29. Самсыгина, Г.А. Гипоксическое поражение центральной нервной системы у новорожденных детей: клиника, диагностика, лечение /Г.А. Самсыгина. //Педиатрия. — 1996. — № 5. — С. 74-77.
30. Самсыгина, Г.А. Влияние перинатальной гипоксии легкой степени на развитие плода и новорожденного /Г.А. Самсыгина, Т.А. Бим-басова, Л.Ю. Неижко. //Педиатрия. — 1995. — № 2. — С. 20-23.
31. Серов, В.Н. Практическое акушерство: Руков. для врачей /В.Н. Серов, А.Н. Стрижаков, С.А. Маркин. — М., 1989. — 512 с.
32. Сидорова И.С., Макаров И.О. //Вест. Рос. АМН. — 1994. — № 2. -С. 25-31.
33. Тюкова, Н.В. Клинико-электрокардиографические особенности нарушений сердечного ритма у новорожденных с перинатальной
гипоксией /Н.В. Тюкова, Л.И. Меньшикова, В.И. Макарова. //Вест. аритмологии. — 2000. — № 19. — С. 61-63.
34. Фазлеева, Л.К. Реабилитация новорожденных с признаками поражения ЦНС в раннем неонатальном периоде /Л.К. Фазлеева, Л.В. Городецкая, Л.Е. Булгакова. //Матер. респ. н.-пр. конф. «Перинатальная патология, вопросы диагностики, клиника, реабилитация». — Ульяновск, 1995. — С. 24-25.
35. Цой, Е.Г. Вариабельность сердечного ритма в оценке и коррекции дизадаптационных сдвигов у доношенных новорожденных, перенесших хроническую внутриутробную гипоксию /Е.Г. Цой: Ав-тореф. дис. … канд. мед. наук. — Новосибирск, 2001. — 21 с.
36. Шабалов, Н.П. Неонатология. Т.1 /Н.П. Шабалов. — СПб., 1995. -С. 215-227.
37. Шраер, О.Т. Фетоплацентарная недостаточность /О.Т. Шраер. //Мать и Дитя в Кузбассе. — 2000. — № 1. — С. 42-45.
Шраер, О.Т. Фетоплацентарная недостаточность /О.Т. Шраер. //Мать и Дитя в Кузбассе. — 2000. — № 1. — С. 42-45.
38. Яцык, Г.В. Эффективность метаболической коррекции нарушений клеточной адаптации у недоношенных детей с гипоксией /Г.В. Яцык, А. Валюлис. // Педиатрия. — 1993. — № 3. — С. 106-107.
39. Dubinsky, J. M. Examination of the Role of Calcium in Neuronal Death /J.M. Dubinsky. //In: Markers of Neuronal Injury and Degeneration (ed. Johannessen J.N.). — N.Y., N.Y. Academy of Sciences, 1993. -Vol. 679. — P. 34-42.
40. Gibbons, S.J. Calcium Influx and Neurodegeneration /Gibbons S.J., Brorson J.R., Bleakman D. //In: Markers of Neuronal Injury and Degeneration (ed. Johannessen J.N.). — N.Y., N.Y. Academy of Sciences, 1993. — Vol. 679. — P. 22-33.
41. Kaada, B. Sudden infant death — the QT interval in ECG and brad-yarrhythmias /Kaada B. //Tidsskr Nor Laegeforen. — 1989. — Vol. 109, N 2. — P. 186-192.
42. Nyakas C., Buwalda B., Luiten P.G.M. //Progress in Neurobiology. -1996. — Vol. 49. — P. 1-51.
43. Schaywitz, B.A. The sequelae of hypoxic-ischemic encephalopathy /Schaywitz B.A. //Semin. Perinatol. — 1987. — T. 11, № 2. — P. 180-191.
44. Williams, C.E. Pathophysiology of perinatal asphyxia /Williams C.E., Mallard E.D., Fan W.K.M. //Clin. Perinatol. — 1993. — № 20. -P. 305-309.
Британские медики требуют принять новый термин — «синдром внезапной смерти взрослого», к которому будут относиться случаи гибели здоровых людей без каких-либо видимых причин. Они заявили, что в свое время введение термина «синдром внезапной младенческой смерти» позволило добиться регистрации этого явления, изучить его и всего за десять лет снизить его частоту на 70 %.
В ходе исследования, проведенного специалистами Британского фонда сердца, установлено, что только в Англии 3500 считавшихся здоровыми взрослых внезапно умирают каждый год. Примерно в 150 случаях не удается найти какой-то причины. Некоторые полагают, что смерть наступает в результате электрических нарушений в сердечной мышце, но установить это у умершего уже нельзя.
Однако это может быть только вершиной айсберга. Из-за отсутствия четкого диагноза оценить истинные масштабы явления достаточно сложно. Как заявил руководитель работы доктор Тим Боукер (Tim Bowker), есть основания относить непонятные случаи к «взрослому» эквиваленту внезапной младенческой смерти. Пока же коронеры используют разные формулировки, что затрудняет понимание явления.
«Пока не будет введена практика выявления всех необъяснимых смертей и соответствующего их обозначения, не будет возможности изучать их систематически, назвать причины и найти пути их предупреждения. Название, которые мы предлагаем — синдром внезапной смерти взрослого», — добавил автор исследования, руководящий медицинскими исследованиями фонда.
(МедНовости.ру: http://www.mednovosti.ru)
Гипоксия у Новорожденных (её Последствия и Лечение)
Все чаще наблюдается гипоксия у новорожденных, причем этот диагноз остается непонятным и пугающим для многих молодых мамочек. Именно поэтому необходимо разобраться в том, что же скрывается под таким термином, как лечить заболевание, какие последствия гипоксии у новорожденного могут быть и какие профилактические меры можно принять, чтобы избежать этого диагноза.
Содержание
Что значит: родился с гипоксией
Причины гипоксии у новорожденного
Лечение гипоксии у новорожденных
Что значит: родился с гипоксией
Каждая женщина, ожидающая появление своего дитя на свет, старается сделать все, зависящее от нее, чтобы ребенок родился здоровым. Но, в силу неблагоприятных особенностей экологии, качества продуктов, не все зависит от будущей мамы.
Но, в силу неблагоприятных особенностей экологии, качества продуктов, не все зависит от будущей мамы.
Гипоксия головного мозга — состояние либо острой нехватки кислорода, либо снижение способности клеток его поглощать.
В результате в организме происходит ряд изменений. Если такое состояние возникает разово — то системы органов начинают работать в ускоренном режиме для увеличения скорости циркуляции крови, а, следовательно, и объема кислорода, поступающего вместе с ней.
В случае если такое состояние затягивается, например, на протяжении всей беременности, в организме происходят губительные, подчас необратимые изменения для плода.
Это нарушение в системе снабжения кислородом плода при беременности определяется через наблюдение за поведением ребенка в утробе, а также плановые скрининговые исследования.
Причины гипоксии у новорожденного
Гипоксия у ребенка может возникать не только в утробе матери, но и при самих родах.
Это может произойти по следующим причинам:
- Длительные или трудные естественные роды. В ситуации, когда ребенок проходит по родовым путям слишком медленно, в силу самых разных причин, например, крупного размера плода, его неправильного положения, индивидуальных особенностей организма матери. В результате – ребенок, покинув водную среду, оказывается в бескислородном пространстве. Кроме того, его дыхательные пути могут перекрывать остатки родовых вод.
- Оперативные роды. Так как ребенок не проходит естественного родового пути, механизм дыхания может сразу не запустится, отсюда и гипоксия.
- Инструментальные особенности родов. Если специалистам приходится использовать специальные инструменты, такие как щипцы, или применять медицинские препараты в условиях сложных родов, это также может вызвать недуг у ребенка.

Правда, гипоксия новорожденного имеет яркие признаки, поэтому обычно специалистами сразу ставится точный диагноз, и ребенку оказывают первую помощь. В зависимости от степени тяжести заболевания определяется необходимость дальнейшего лечения.
- В случае легкой степени — состояние ребенка улучшается уже через несколько минут после рождения и проведения процедур по очистке дыхательных путей крохи.
- При средней тяжести — ребенку для восстановления нормального функционирования организма может понадобиться несколько дней специализированного лечения.
- При тяжелой степени ребенку необходима срочная реанимация и длительное лечение во избежание необратимых нарушений в организме ребенка.
Лечение гипоксии у новорожденных
Эффективность лечения гипоксии зависит от слаженности в действиях специалистов, принимающих роды.
В первую очередь, необходимо очистить дыхательные пути ребенка, чтобы обеспечить ему свободное дыхание, а также восстановить нормальный температурный режим кожи, что улучшает циркуляцию крови. Для этого ребенка прогревают под специальной лампой. В тяжелых случаях ребенку может понадобиться кислородная маска и помещение его в специальную барокамеру.
Если при родах наблюдалась гипоксия, независимо от степени ее тяжести, необходимо проводить профилактические мероприятия для восстановления и поддержания нормальной работы дыхательной системы, а также оберегать нервную систему ребенка от любых даже самых незначительных стрессов.
Кроме того, если ребенку при рождении поставили такой диагноз, необходимо встать на учет к невропатологу, чтобы возможные последствия гипоксии у новорожденного были вовремя обнаружены. При длительном кислородном голодании ребенок в будущем может несколько отставать в развитии от своих сверстников, поэтому необходимо тщательно выполнять все рекомендации врача с целью этого избежать.
Для лечения и устранения последствий кислородного голодания грудничкам назначают специальный лечебный массаж. Полезны расслабляющие ванны и сеансы ароматерапии, а также лечебная гимнастика.
Лечение гипоксии головного мозга у новорожденных медикаментозными методами проводится только в случае, если степень ее проявления средняя или тяжелая. Ребенку могут назначить препараты, стимулирующие деятельность головного мозга и усиливающие его кровоснабжение.
В особенно тяжелых случаях могут понадобиться противосудорожные препараты и переливание крови. Важно не допустить развитие болезни до степени асфиксии, так как в этом случае гипоксия головного мозга у новорожденных может привести к его гибели.
Если ребенку своевременно была оказана помощь, гипоксия у новорожденного обычно достаточно быстро проходит не оставляя никаких напоминаний о себе, и уже скоро малыш будет радовать вас своими достижениями.
Гипоксия плода — видео
Развитие детей, перенесших острую и хроническую гипоксию
На правах рукописи —
Пронина Ольга Александровна
РАЗВИТИЕ ДЕТЕЙ, ПЕРЕНЕСШИХ ОСТРУЮ И ХРОНИЧЕСКУЮ ГИПОКСИЮ
14,00.09 — педиатрия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата медицинских наук
Воронеж — 2009
003469525
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Воронежская государственная медицинская академия им. H.H. Бурденко Федерального агентства по здравоохранению и социальному развитию» (ГОУ ВПО ВГМА им. H.H. Бурденко Росздрава)
Научный руководитель: Официальные оппоненты:
Ведущая организация:
доктор медицинских наук, профессор Логвинова Ия Ивановна
доктор медицинских наук, профессор Ситникова Валентина Пантелеевна кандидат медицинских наук Савченко Андрей Пантелеевич
ГОУ ВПО «Волгоградский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Защита диссертации состоится «2» июня 2009 года в 10°° часов на заседании диссертационного совета Д. 208.009.02 при ГОУ ВПО ВГМА им. H.H. Бурденко Росздрава по адресу: 394036, Россия, г. Воронеж, ул. Студенческая, д. 10.
208.009.02 при ГОУ ВПО ВГМА им. H.H. Бурденко Росздрава по адресу: 394036, Россия, г. Воронеж, ул. Студенческая, д. 10.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО ВГМА им. H.H. Бурденко Росздрава
Автореферат разослан «30» апреля 2009 года.
Ученый секретарь диссертационного совета
A.B. Будневский
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность
Перинатальная гипоксия занимает одно из ведущих мест среди перинатальных факторов, оказывающих влияние не только на состояние плода, но и на особенности течения периода новорожденное™, что, в конечном итоге, сказывается на здоровье и дальнейшем развитии ребенка (Баранов A.A., 2001, Балаболкин И.И., 2003). По данным Барашнева Ю.И. (2005) внутриутробная гипоксия и гипоксия в родах в 38,45% случаев является причиной перинатальной смертности, а в 59,04% — причиной мертворождений. Частота перинатальной гипоксии не имеет тенденции к уменьшению. 60-80% всех заболеваний ЦНС детского возраста связано с перинатальной гипоксией (Бадалян Л.О., 2001). Более половины всех случаев расстройств функций ЦНС у детей раннего возраста обусловлено не острой гипоксией в родах, а длительной, хронической гипоксией плода и новорожденного (Paneth N., 1983, Nelsons К.В., 1996, Volpe J.J., 2008). Значимость проблемы состоит в том, что поражения головного мозга гипоксического генеза определяют неврологическое здоровье и инвалидность с детства (Пальчик А.Б,, 2001; Барашнев Ю.И., 2005). Необходим поиск комплекса современных клинических и лабораторных критериев, позволяющих улучшить раннюю диагностику и прогноз повреждений нервной системы у детей. Своевременное выявление постгипоксических нарушений имеет огромное значение для построения адекватной терапии неврологических расстройств и их профилактики (Барашнев Ю.И., 1991, Баранов A.A., 2006).
На современном этапе развития медицинской науки установлено, что гипоксия, ишемия, ацидоз индуцируют синтез эндотелина-1 (ЭТ-1) (Isozaki-Fukuda Y. , 1991, Антонов А.Г., 2006). ЭТ-1 оказывается причастным к сердечно-сосудистой и почечной патологии, диабету (La М., 1995, Gray G., 1996, Pernow J., 1997, Rhoten R., 1997, Schiffrin E.L., 2001, D. Behrendt, 2002, Touyz RM, 2003,), а также участвует в патогенезе легочной гипертензии и постгипоксических нарушений сердечно-сосудистой системы у новорожденных (Kumar Р, 1996, Perreault Т, 2003, Зузенкова Л.В., 2008). Роль ЭТ-1 в развитии перинатальных гипоксических поражений ЦНС и их исходов у новорожденных изучена недостаточно.
, 1991, Антонов А.Г., 2006). ЭТ-1 оказывается причастным к сердечно-сосудистой и почечной патологии, диабету (La М., 1995, Gray G., 1996, Pernow J., 1997, Rhoten R., 1997, Schiffrin E.L., 2001, D. Behrendt, 2002, Touyz RM, 2003,), а также участвует в патогенезе легочной гипертензии и постгипоксических нарушений сердечно-сосудистой системы у новорожденных (Kumar Р, 1996, Perreault Т, 2003, Зузенкова Л.В., 2008). Роль ЭТ-1 в развитии перинатальных гипоксических поражений ЦНС и их исходов у новорожденных изучена недостаточно.
В связи с изложенным выше, изучение дальнейшего физического, нервно-психического развития, соматической заболеваемости, оптимизация диагностики и прогнозирования неврологической патологии у детей, перенесших острую и хроническую перинатальную гипоксию, а также изучение роли ЭТ-1 в развитии неврологических расстройств у детей являются весьма актуальными.
Цель исследования
Провести мониторинг развития детей, перенесших острую и хроническую перинатальную гипоксию, а также определить роль ЭТ-1 в
развитии неврологических расстройств гипоксического генеза у детей и выявить наиболее значимые факторы, влияющие на их компенсацию.
Задачи исследования
1. Изучить течение раннего неонатального периода у детей, перенесших острую и хроническую гипоксию.
2. Оценить физическое развитие детей до 3-х лет, перенесших острую, хроническую и сочетанную перинатальную гипоксию.
3. Провести анализ соматической заболеваемости у детей до 3-х лет, перенесших внутриутробную и интранатальную гипоксию.
4. Сравнить неврологические нарушения и сроки их компенсации, в зависимости от вида перенесенной гипоксии.
5. Определить факторы, влияющие на наступление неврологической компенсации после 1,5 лет у детей, перенесших перинатальную гипоксию.
6. Изучить роль ЭТ-1 в развитии неврологических расстройств у новорожденных.
Новизна исследования
Установлены особенности течения раннего неонатального периода, физического развития, соматической заболеваемости у детей, перенесших острую, хроническую и сочетанную гипоксию.
Выявлены особенности неврологических нарушений и сроки их компенсации, в зависимости от вида перенесенной гипоксии.
Определен прогностический вклад факторов, влияющих на позднее наступление неврологической компенсации у детей, перенесших перинатальную гипоксию.
Выявлена диагностическая и прогностическая значимость ЭТ-1 в развитии ХВГП и неврологических нарушений у детей, перенесших внутриутробную гипоксию.
Практическая значимость
Определены особенности течения раннего неонатального периода, физического развития, соматической заболеваемости, неврологических нарушений и сроки их компенсации у детей, в зависимости от вида перенесенной гипоксии.
Установлено, что определение концентрации ЭТ-1 в плазме пуповинной крови и в период ранней неонатальной адаптации у детей с высоким риском хронической внутриутробной гипоксии позволяет судить о наличии постгипоксических нарушений. Показатели ЭТ-1 могут служить критерием раннего прогнозирования развития последствий перинатального поражения ЦНС у детей на первом году жизни.
Выявлено, что для прогнозирования сроков компенсации неврологических расстройств у детей с перинатальной гипоксией (при условии стандартных методов лечения) необходима комплексная оценка
группы факторов, включающих антенатальное развитие и интранатальный период, неонатальную заболеваемость и данные нейросонографии, заболеваемость на протяжении первых 3-х лет жизни.
Предложено комплексное обследование и наблюдение детей, перенесших перинатальную гипоксию, включающее в себя определение ЭТ-1 в пуповинной крови, оценку физического развития с обязательным ежемесячным определением окружностей головы и груди на протяжении 11,5 лет, оценку неврологического и соматического статуса, обязательное проведение нейросонографии не однократно, даже при отсутствии патологии при предыдущих исследованиях. Данный комплекс обследования позволяет выявить в более ранние сроки наличие соматических и неврологических расстройств, а также способствует определению «клинически немых» форм поражения головного мозга и своевременной коррекции выявленных нарушений.
Внедрение в практику
Рекомендации, разработанные на основании полученных в ходе диссертационного исследования данных, используются в учебном процессе на кафедре неонатологии ГОУ ВПО ВГМА им. H.H. Бурденко Росздрава.
Основные положения, выносимые иа защиту:
1. Особенности течения раннего неонатального периода, физического развития, соматической заболеваемости, неврологических нарушений и сроки их компенсации у детей, в зависимости от вида перенесенной гипоксии, необходимо учитывать для профилактики развития постгипоксических нарушений у детей сразу после рождения и в раннем возрасте.
2. Определение концентрации ЭТ-1 в плазме пуповинной крови и в период ранней неонатальной адаптации у детей с высоким риском хронической внутриутробной гипоксии позволяет судить о наличии постгипоксических нарушений. Показатели ЭТ-1 в пуповинной крови могут служить критерием раннего прогнозирования развития последствий перинатальных поражений ЦНС у детей на первом году жизни.
3. Для прогнозирования сроков компенсации неврологических расстройств у детей с перинатальной гипоксией (при условии стандартных методов лечения) необходима комплексная оценка группы материнских факторов и факторов, относящихся к состоянию ребенка.
4. Детям, перенесшим перинатальную гипоксию, необходимо комплексное обследование и наблюдение для выявления в более ранние сроки наличия соматических и неврологических расстройств и своевременной их коррекции.
Апробация работы
Основные результаты работы были представлены на III, V, VI Всероссийских университетских научно-практических конференциях молодых ученых и студентов по медицине (Тула, 2004, 2006, 2007), I Всероссийской Бурденковской студенческой научной конференции (Воронеж, 2005), X конгрессе педиатров России (Москва, 2006), Ежегодной междисциплинарной научно-практической конференции стран СНГ (Санкт-Петербург, 2006), ежегодном конгрессе специалистов перинатальной медицины (Москва, 2006), Первом Объединенном научно-практическом форуме детских врачей (Орел, 2008), И научно-практической конференции «Актуальные вопросы организации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара» (Воронеж, 2008).
Публикации
По материалам диссертации опубликовано 10 работ, две из которых в издании, рекомендованном ВАК РФ.
Объем и структура диссертации
Диссертация изложена на 144 страницах машинописного текста, состоит из введения, обзора литературы, главы, посвященной объекту и методам исследования, трех глав собственных исследований, заключения, выводов, практических рекомендаций, указателя литературы. Работа иллюстрирована 10 рисунками и 37 таблицами, содержащимися в тексте. Библиография содержит 286 источников, в том числе 179 отечественных и 107 иностранных авторов.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Объект и методы исследования
Проведено обследование 157 детей, В данное исследование были включены дети, перенесшие ХВГП и асфиксию новорожденного, со сроком гестации от 37 до 42 недель, рожденные в роддоме «Электроника» и областном родильном доме в 2002-2005 гг. Критериями исключения новорожденных из исследования стали срок гестации менее 37 недель, травматические повреждения и поражения ЦНС при инфекционных заболеваниях перинатального периода, а также врожденные пороки развития.
Перенесенная детьми гипоксия подтверждалась данными повторных (не менее двух) кардиотокографических и ультразвуковых исследований во 2-м и 3-м триместрах беременности, а также антенатальными и интранатальными факторами риска. Асфиксия новорожденного
устанавливалась согласно критериям диагностики — оценка по шкале Апгар и наличие клинических признаков полиорганных нарушений.
Дети были разделены на пять групп. Первая (контрольная) группа состояла из 30 здоровых доношенных новорожденных, матери которых не имели кардиотокографических признаков страдания плода и ультразвуковых признаков ФПН. Вторую группу составили 25 новорожденных с оценкой по шкале Апгар 4-6 баллов, матери которых также не имели кардиотокографических и ультразвуковых признаков хронической гипоксии плода, т.е. перенесших острую умеренную асфиксию в родах. В третью группу вошло 39 детей с признаками хронической внутриутробной гипоксии плода, не достигающими критических значений. В четвертой группе было 27 новорожденных, перенесших умеренную асфиксию в родах, развившуюся на фоне хронической антенатальной гипоксии. Пятую группу составили 36 детей, рожденных в тяжелой асфиксии на фоне хронической внутриутробной гипоксии плода. Основные характеристики детей представлены в таблице 1.
В третью группу вошло 39 детей с признаками хронической внутриутробной гипоксии плода, не достигающими критических значений. В четвертой группе было 27 новорожденных, перенесших умеренную асфиксию в родах, развившуюся на фоне хронической антенатальной гипоксии. Пятую группу составили 36 детей, рожденных в тяжелой асфиксии на фоне хронической внутриутробной гипоксии плода. Основные характеристики детей представлены в таблице 1.
Таблица 1
1 группа (п=30) 2 группа (п=25) 3 группа (п=39) 4 группа (п=27) 5 группа (п=36)
Мальчики/ Девочки (абс(%) 15/15 (50/50) 17/8 (68/32) 14/25 (36/64) 12/15 (44/56) 21/15 (58/42)
Масса тела при рождении, г (М±а) 3509 ±345 3600 ±398 3247 ±339* 3200 ±289* 3394 ±332
Длина тела при рождении, см (М±сг) 53,1 ±1,7 53,8 ±1,9 51,7 ±2,0 52,3 ±2,5 53 ±2,7
Окружность головы, см (М±ст) 34,6 ±1,0 35,2 ±1,1 34,4 ±1,2 34,6 ±1,4 34,1 ±1,7
Окружность груди, см (М±о) 32,5 ±1,6 33,0 ±1,7 31,9 ±1,6 32,1 ±1,7 32,4 ±1,6
Гестационный возраст, нед (М±о) 39,1 ±0,7 39,5 ±1,0 39,1 ±0,9 38,9 ±0,8 39 ±0,9
Оценка по шкале Апгар 1 мин/5 мин (М±о) 7,0/8,0 5,8±0,5/ 7,0±0,5 7,0/ 7,9±0,2 5,9±0,3/ 7,15±0,4 2,0±0,8/ 4,8±1,3
Примечание: * р<0,01 между группами контроля, «с умеренной асфиксией» и группами «с ХВГП», «с ХВГП+ умеренная асфиксия»
Отмечалось отличие по массе тела в группах детей с перенесенной хронической и сочетанной гипоксией с умеренной асфиксией от контрольной группы и группы детей, перенесших острую умеренную асфиксию. Отличие между группами отмечалось также по тяжести состояния при рождении и оценивалось по шкале Апгар.
Обследование новорожденных в родильном доме включало оценку состояния при рождении по шкапе Апгар, морфофункциональной зрелости
и физического развития, неврологического и соматического статуса, общеклиничекие лабораторные исследования.
Последующее наблюдение за детьми осуществлялось до достижения ими трёхлетнего возраста. Пациентам проводился комплекс клинических, лабораторных и инструментальных исследований в динамике. Все дети были консультированы неврологом, офтальмологом, хирургом.
Пациентам проводился комплекс клинических, лабораторных и инструментальных исследований в динамике. Все дети были консультированы неврологом, офтальмологом, хирургом.
Оценка физического развития детей в возрасте от 1 месяца до 3-х лет проводилась с использованием центильных таблиц И.М. Воронцова и А.Н. Мазурина соответственно возрасту и полу. Уровень психомоторного развития определялся по методике Л.Т. Журбы и Е.М. Мастюковой (1981), а также с использованием методики В.А. Доскина и соавторов (1997). Ультразвуковое исследование головного мозга проводилось аппаратом «Бшепз 80-450» (Германия), секторными датчиками 3,5 и 7,5 МГц.
С целью изучения состояния функций эндотелия у новорожденных, перенесших ХВГП, была определена концентрация ЭТ-1 в плазме крови у детей со сроком гестации 37-42 недели, рожденных в областном роддоме в 2007 году. Нами был обследован 41 ребенок, которые на основании анамнестических, клинических данных, кардиотокографии и допплерометрии перенесли хроническую внутриутробную гипоксию. Эти дети вошли в основную группу. Группу сравнения составили 12 новорожденных, родившихся у матерей с не осложненным течением беременности и родов. В ходе исследования дети основной группы, перенесшие ХВГП, были разделены на 2 подгруппы. В 1А подгруппу вошло 15 детей, которые в раннем неонатальном периоде не имели признаков гипоксически-ишемического поражения ЦНС. 1Б подгруппу составили 26 детей, имеющие в раннем неонатальном периоде признаки церебральной ишемии I и II степени. Общая характеристика обследуемых пациентов представлена в таблице 2.
Таблица 2
Общая характеристика групп детей, обследуемых на эндотелиальную
дисфункцию
Основная группа Группа сравнения (п=12)
1А подгруппа (п=15) 1Б подгруппа (п=26)
Мальчики/ Девочки (абс(%) 4/11 (27/73) 15/11. (58/42) 6/6 (50/50)
Масса тела при рождении, г (М±о) 3706±224 3246±504* 3615±486
Длина тела при рождении, см (М±сг) 54,2±1,5 52,8±2,1 54±2,8
Окружность головы, см (М±а) 35±1,2 33,9±1,3 35,1±1,4
Окружность груди, см (М±о) 33,6±1,4 32,5±1,5 33,6±1,0
Гестационный возраст, нед (М±о) 39,2±0,9 39,2±0,88 38,8±0,22
Примечание: * р<0,05 между 1А подгруппой, группой сравнения и 1Б подгруппой
Оценка по шкале Апгар у всех детей составила 7-8 баллов. Отмечалось отличие по массе тела в подгруппе детей с церебральной ишемией от контрольной группы и подгруппы без поражения ЦНС.
Отмечалось отличие по массе тела в подгруппе детей с церебральной ишемией от контрольной группы и подгруппы без поражения ЦНС.
Количественное определение ЭТ-1 в ЭДТА-плазме производили с помощью иммуноферментного анализа (набор Biomedica).
Последующее наблюдение за детьми, у которых был определен ЭТ-1 в крови, осуществлялось на протяжении первого года жизни с оценкой физического и психомоторного развития, изучением соматической и неврологической патологии, проведением ультразвукового исследования головного мозга.
Статистическая обработка
Статистическая обработка полученных результатов проводилась на персональном компьютере с помощью пакета универсальных программ «Excel» и «Statistica v.6» с использованием общепринятых параметрических и непараметрических методов. Обработка вариационных рядов включала подсчет значений средних арифметических величин (М), стандартной ошибки (ш), стандартного отклонения (а). Частота признаков представлена с указанием стандартной ошибки для качественных признаков, стандартного отклонения для количественных признаков. Для сравнения средних величин количественных переменных использовали t-критерий Стьюдента. Качественные показатели сравнивали по критериям Хи-квадрат и Манна-Уитни. Достоверными считались различия между группами при вероятности ошибки менее 5% (р<0,05). Для выявления взаимосвязей между изучаемыми показателями применяли метод корреляционного анализа, включающий как оценку коэффициента корреляции Спирмена (г), так и уровень его значимости (р). Определение факторов риска поздней (после 1,5 лет) неврологической компенсации проводилось с помощью многомерного регрессионного анализа с 95% доверительным интервалом.
Результаты исследований
Был проведен анализ антенатального, интранатального и раннего постнатального периодов каждого ребенка.
Средний возраст матерей в группах «с ХВГП» (3 группа — 26,33±5,90 лет), «с ХВГП + умеренная асфиксия» (4 группа — 28,48±4,95 лет), «с ХВГП + тяжелая асфиксия» (5 группа — 26,56±6,31 лет) достоверно не отличался между группами и от контроля (1 группа — 27,93±6,06 лет). Средний возраст матерей в группе «с умеренной асфиксией» (2 группа) составил 25,08±3,7б лет и достоверно отличался от контрольной группы и от группы «с ХВГП + умеренная асфиксия» (р<0,05). Следует отметить, что в группе «с ХВГП» и обеих группах с сочетанной гипоксией, а также в контрольной группе, женщины старше 35 лет встречались примерно с одинаковой частотой (в 1, 3, 4 группах — по 5 женщин (16,7%, 12,8%, 18,5% соответственно), в 5 группе — 6 (16,7%) женщин). В группе «с умеренной асфиксией» женщины старше 35 лет не встречались.
Средний возраст матерей в группе «с умеренной асфиксией» (2 группа) составил 25,08±3,7б лет и достоверно отличался от контрольной группы и от группы «с ХВГП + умеренная асфиксия» (р<0,05). Следует отметить, что в группе «с ХВГП» и обеих группах с сочетанной гипоксией, а также в контрольной группе, женщины старше 35 лет встречались примерно с одинаковой частотой (в 1, 3, 4 группах — по 5 женщин (16,7%, 12,8%, 18,5% соответственно), в 5 группе — 6 (16,7%) женщин). В группе «с умеренной асфиксией» женщины старше 35 лет не встречались.
Анализ соматической заболеваемости показал, что все женщины до наступления настоящей беременности имели ту или иную соматическую патологию. Во всех группах, включая контрольную, женщины имели высокий процент патологии (69,4% до 96,2%). Осложненный соматический анамнез встречался достоверно чаще только в группе «с ХВГП + умеренная асфиксия» (96,2%), чем во всех остальных (р<0,01). Более половины матерей в группах детей с перенесенной острой и/или хронической гипоксией имели осложненный гинекологический анамнез. В группе «с умеренной асфиксией» преобладали воспалительные (56%), а в группе «с ХВГП» невоспалительные (53,8%) болезни женских половых органов. У матерей в группах «с ХВГП + умеренная асфиксия» и «с ХВГП + тяжелая асфиксия» воспалительные и невоспалительные гинекологические заболевания встречались с одинаковой частотой (по 55,6% и 41,6% соответственно). В контрольной группе осложненный гинекологический анамнез имела четвертая часть женщин. Первая беременность регистрировалась почти у половины женщин в группах контроля, «с ХВГП» и «с ХВГП + тяжелая асфиксия». В группе «с ХВГП + умеренная асфиксия» одна треть детей была рождена от первой беременности. Течение беременности в группах детей с хронической и сочетанной гипоксией (3, 4, 5 группы) осложнилось гестозом второй половины у всех женщин. В 3-й, 4-й и 5-й группах у четверти, одной трети и почти у половины матерей, соответственно, гестоз был в виде нефропатии различной степени. Примерно у половины матерей в этих группах регистрировались анемия беременных, ранний токсикоз и угроза прерывания, каждая пятая женщина перенесла ОРВИ во время беременности. Течение беременности в группе «с умеренной асфиксией» осложнилось более чем у половины матерей анемией беременных, ранним токсикозом, водянкой беременных и угрозой прерывания, которая отмечалась однократно и без длительного лечения, каждая пятая перенесла ОРВИ во время беременности. В контрольной группе однократная угроза прерывания беременности регистрировалась в два раза, водянка беременных в пять раз, а токсикоз в семь раз реже, чем в группах с гипоксией (р<0,001).
Примерно у половины матерей в этих группах регистрировались анемия беременных, ранний токсикоз и угроза прерывания, каждая пятая женщина перенесла ОРВИ во время беременности. Течение беременности в группе «с умеренной асфиксией» осложнилось более чем у половины матерей анемией беременных, ранним токсикозом, водянкой беременных и угрозой прерывания, которая отмечалась однократно и без длительного лечения, каждая пятая перенесла ОРВИ во время беременности. В контрольной группе однократная угроза прерывания беременности регистрировалась в два раза, водянка беременных в пять раз, а токсикоз в семь раз реже, чем в группах с гипоксией (р<0,001).
Наличие внутриутробного страдания плода подтверждалось проведением КТГ и ультразвуковых допплерометрических исследований. Базальный ритм и ПСП в группах с хронической и сочетанной гипоксией был достоверно выше, чем в 1-й и 2-й группах (р<0,001). В группах с хронической гипоксией и сочетанной умеренной и тяжелой асфиксией выраженное страдание плода отмечалось более чем у половины женщин. В контрольной группе и в группе «с умеренной асфиксией» при кардиотокографическом исследовании патологии не выявлено. Допплерометрическое исследование показало наличие признаков ФПН в группах с хронической и сочетанной гипоксией у всех женщин, тогда как в группе «с умеренной асфиксией» только у 28% беременных (р<0,05). Необходимо отметить, что во 2-й группе встречалась только 1а степень ФПН. В контрольной группе плацентарный кровоток не нарушался.
Самостоятельные роды превалировали в контрольной группе у 66,7% и в группе «с ХВГП» у 53,8% женщин, из них физиологическими были 45% и 23,8% случаев соответственно. В группах «с умеренной асфиксией», «с ХВГП + умеренная асфиксия» и «с ХВГП + тяжелая асфиксия» ни у одной женщины роды не протекали физиологически. Аномалии родовой деятельности в группе «с ХВГП + тяжелая асфиксия» в два раза чаще осложняли течение родов, чем в контрольной группе (р<0,05). Во всех группах с перенесенной гипоксией практически половина родов осложнилась патологией пуповины, что достоверно чаще по сравнению с контролем (р<0,05). Дородовое излитие околоплодных вод в группах «с ХВГП + тяжелая асфиксия» и «с ХВГП» наблюдалось у каждой третьей женщины, что чаще, чем в группах «с умеренной асфиксией» и контроля. Меконий в околоплодных водах встречался примерно у каждой пятой женщины во всех группах с гипоксией.
Дородовое излитие околоплодных вод в группах «с ХВГП + тяжелая асфиксия» и «с ХВГП» наблюдалось у каждой третьей женщины, что чаще, чем в группах «с умеренной асфиксией» и контроля. Меконий в околоплодных водах встречался примерно у каждой пятой женщины во всех группах с гипоксией.
При анализе течения раннего неонатального периода выявлено, что в контрольной группе наблюдалась низкая заболеваемость. Только у 20% детей встречалась конъюгационная желтуха. В группах с перенесенной гипоксией (2, 3, 4, 5 группы) общая заболеваемость достоверно выше, чем в контрольной группе (р<0,001), и составила от 74,1 до 100%. В 5-й группе наблюдалась самая высокая заболеваемость по сравнению с другими группами (р<0,01). На первом месте во всех группах с перенесенной асфиксией стоят дыхательные и сердечно-сосудистые нарушения, ВЖК также превалировали в этих группах (14-16%). Транзиторное тахипноэ новорожденного достоверно чаще встречалось в 5-й группе, чем в остальных группах с гипоксией (р<0,01). ЗВУР регистрировалась только у детей с хронической гипоксией (3,4, 5 группа) от 14% до 33,3%.
Неврологическая патология в группе «с ХВГП + тяжелая асфиксия» так же, как и соматическая, наблюдалась чаще, чем в других группах. Гипоксическое поражение ЦНС имели все новорожденные этой группы, тогда как во 2-й, 3-й и 4-й группах церебральная ишемия была выявлена у 48%, 38,5%, 59,3% детей соответственно. Ведущим неврологическим синдромом в группах «с умеренной асфиксией», «с ХВГП» и «с ХВГП + умеренная асфиксия» явился гипертензионный синдром (28%, 20,5% и 22,2% соответственно), а в группе «с ХВГП + тяжелая асфиксия» — синдром гипервозбудимости и синдром угнетения (38,9% и 36,1% соответственно). В группе «с ХВГП + тяжелая асфиксия» судорожный синдром встречался у 13,9% детей, а в группе «с умеренной асфиксией» в 4% случаев.
Всем детям были исследованы в капиллярной крови на 1-е и на 5-е сутки концентрация гемоглобина и количество эритроцитов, повышение которых является адаптационным механизмом при кислородной недостаточности. Концентрация гемоглобина и количество эритроцитов на 1-е сутки и количество эритроцитов на 5-е сутки в группе «с ХВГП + тяжелая асфиксия», были достоверно выше, чем в остальных группах. Концентрация гемоглобина на 5-е сутки в группах достоверно не отличалась.
Концентрация гемоглобина и количество эритроцитов на 1-е сутки и количество эритроцитов на 5-е сутки в группе «с ХВГП + тяжелая асфиксия», были достоверно выше, чем в остальных группах. Концентрация гемоглобина на 5-е сутки в группах достоверно не отличалась.
Катамнез детей исследуемых групп
На естественном вскармливании в контрольной группе находилось 76,5% детей, а в группе «с умеренной асфиксией» — 50% детей. Более половины детей в группах с хронической и сочетанной гипоксией вскармливались искусственно (3 группа — 52,3%, 4 группа — 57,1%, 5 группа — 77,8% детей).
При изучении физического развития к вариантам нормы были отнесены характеристики, свойственные 80% популяции и находящиеся в интервале от 10-го до 90-го центиля. К году в группах детей с перенесенной гипоксией от 15% до 50% детей имели дисгармоничное физическое развитие с избытком массы тела. В контрольной группе дисгармоничное физическое развитие с избытком массы тела наблюдалось только у 11,8%. Масса и длина тела ниже 10 центиля на первом году жизни встречалась лишь у детей 4-й (7,1%) и 5-й (5,6%) групп. К трем годам во всех группах отмечалась положительная динамика, кроме группы «с ХВГП», в которой количество детей с гармоничным физическим развитием снизилось до 71,4% (рис. 1).
Длина тела Масса тела
Рис. 1 Физическое развитие детей (длина тела, масса тела)
Окружность груди к году в контрольной группе у всех детей укладывалась в возрастные нормативы. В группе «с ХВГП + умеренная асфиксия» каждый пятый ребенок, а в группе «с ХВГП» более половины детей имели узкую грудную клетку. Показатели окружности головы в контрольной группе в изучаемые возрастные периоды (3 месяца, 1 год) у всех обследуемых укладывались в «коридор» от 10 до 90 центиля. В 4-й группе около половины имели показатели окружности головы ниже 10 центиля. У третьей части детей 5-й группы определялись увеличенные размеры окружности головы. К году в группах с хронической гипоксией и сочетанной умеренной и тяжелой асфиксией положительной динамики не
наблюдалось, только у половины детей показатели окружности головы находились между 10 и 90 центилем (рис. 2).
2).
Окружность головы Окружность груди
Рис. 2 Физическое развитие детей (окружность головы, окружность груди)
Анализируя соматическую патологию у детей, перенесших острую и хроническую гипоксию, в контрольной группе была выявлена более низкая заболеваемость, чем в группах сравнения (р<0,05). В раннем возрасте 70,5% пациентов перенесли ОРВИ, но только в одном случае вирусная инфекция сопровождалась бронхитом. В группах с перенесенной гипоксией все дети переносили ОРВИ в течение трех лет, из них 25% отнесены к группе часто болеющих. В группе «с ХВГП + тяжелая асфиксия» у половины детей, а в группе «с ХВГП + умеренная асфиксия» в 35,7% случаев ОРВИ осложнялась обструктивным бронхитом. Дисбиоз кишечника, атопический дерматит и анемия явились ведущими среди соматической патологии, наиболее часто выявляющиеся в группе с тяжелой асфиксией. Достаточно часто диагностировались астигматизм, конъюнктивиты и отиты в группах детей с гипоксией.
Анализ неврологической заболеваемости в поздний неонатальный период показал, что процент диагностируемых гипоксических поражений ЦНС в группах с перенесенной гипоксией увеличился до 95,2% — 100%. Всем детям в возрасте 1 и 6 месяцев проводилась нейросонография. В контрольной группе на первом месяце жизни только у 17,6% детей наблюдались признаки перивентрикулярного отека. Ликвородинамические нарушения в группе «с умеренной асфиксией» определялись у 16,7% детей, что достоверно реже, чем в группе «с ХВГП + тяжелая асфиксия» (р<0,01). В группах с хронической гипоксией и сочетанной умеренной и тяжелой асфиксией нарушения ликвородинамики выявлено более чем у половины детей. При повторном нейросонографичсском обследовании в 6 месяцев в группе «с ХВГП» процент ликвородинамических нарушений снизился в 1,5
раза по сравнению с предыдущим исследованием и составил 33,3%, что достоверно ниже, чем в группе «с ХВГП + тяжелая асфиксия» (р<0,05). В группах с острой и сочетанной гипоксией (2, 4 и 5 группы) частота встречаемости признаков нарушения ликвородинамики увеличилась до 64,3%-72,2% (рис. 3).
3).
80 70 60 50 40 30 20 10 О
— 80 — 70 60 — 50 40 30 — 20 -■ 10 О
Признаки Признаки
ликвородинамических ликворалниймических нарушений (1 мес) нарушений (б мес)
-«с умеренной асфиксие й «
■ «ХВГП+умерення и асфиксия»
«ХВГП+тнжвлая асфиксия»
Рис. 3 Результаты нейросонографического обследования в 1 и 6 мес
На первом году жизни среди последствий гипоксических поражений ЦНС ведущее место принадлежит доброкачественной внутричерепной гипертензии, которая была диагностирована более чем у половины детей с перенесенной гипоксией. Сочетанные формы задержки развития, расстройства вегетативной нервной системы и церебрастенический синдром регистрировались только в группах с хронической и сочетанной гипоксией (3, 4, 5 группы). В группе «с умеренной асфиксией» нарушение моторного развития выявлялось достоверно реже, чем в группах «с ХВГП» и «с ХВГП + тяжелая асфиксия» у одной трети и в группе с «ХВГП + умеренная асфиксия» у половины детей (р<0,05). У 50% пациентов 5-й группы имелись клинические признаки гипервозбудимости. Одному ребенку в группе «с ХВГП + тяжелая асфиксия» был поставлен диагноз ДЦП. Следует отметить, что в контрольной группе неврологической патологии выявлено не было.
К 3-м годам нарушения моторного развития имел каждый пятый ребенок в группах с хронической и сочетанной гипоксией. Нарушения развития речи и гиперкинетические расстройства отмечались более чем у половины детей в группе «с ХВГП + тяжелая асфиксия», что достоверно чаще по сравнению с группами «с ХВГП» и с «ХВГП + умеренная асфиксия» (р<0,05). Дети 4-й и 5-й групп в 14,3 и 22,2% соответственно имели нарушения сна. У пятой части детей группы «с ХВГП + умеренная асфиксия» выявлена сообщающаяся гидроцефалия (рис. 4). В контрольной группе патология со стороны нервной системы к 3-м годам также не регистрировалась, а в группе «с умеренной асфиксией» наступила компенсация неврологических нарушений к году у всех обследуемых.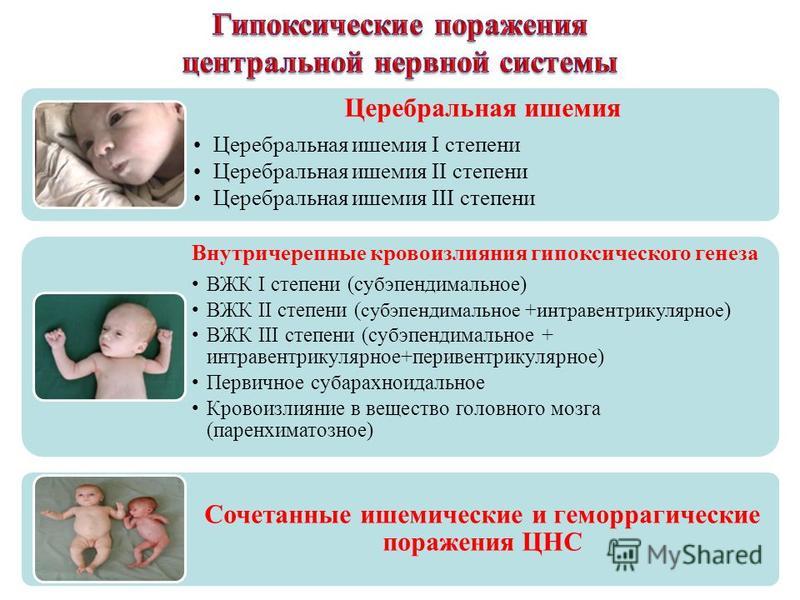
Расстройства сна (С 47)
■ Ко1гтрольняя группа О «с умеренной асфиксией» □ «с ХВГП» ЕЗ «с ХВГШ-умерениан асфиксия» И «с ХВГП+тижеляя асфиксия» _
Рис. 4 Структура неврологической заболеваемости к 3-м годам
Факторы, влияющие на компенсацию неврологических нарушений
На первом этапе исследования влияния некоторых факторов на сроки компенсации неврологических нарушений были построены корреляционные матрицы изучаемых факторов (61 фактор). В ходе исследования проведен корреляционный анализ для выявления факторов, имеющих высокую степень взаимосвязи. Статистически значимо с поздним (после 1,5 лет) наступлением компенсации неврологических нарушений связаны: кардиотокографические признаки страдания плода с коэффициентом корреляции г = 0,66 (р<0,0001), степень ФПН г = 0,69 (р<0,0001), степень тяжести гестоза г = 0,63 (р<0,0001), интубация трахеи г = 0,51 (р<0,0001), концентрация гемоглобина в первые сутки г = 0,45 (р<0,001), гипоксически-ишемическое поражение ЦНС в раннем г = 0,51 (р<0,0001) и позднем неонатальном периоде г = 0,65 (р<0,0001), диффузные изменения тканей мозга гипоксически-ишемического характера г = 0,49 (р<0,0001) и признаки ликвородинамических нарушений г = 0,51 (р<0,0001) при проведении нейросонографии. Слабая корреляционная связь обнаружена между поздней неврологической компенсацией и частыми ОРВИ г = 0,39 (р<0,001). Отмечена отрицательная взаимосвязь поздней неврологической компенсации с оценкой по шкале Апгар на первой г = -0,56 (р<0,0001) и пятой минуте г = -0,52 (р<0,0001), массой тела г = -0,33 (р<0,001) и окружностью головы при рождении г = -0,31 (р<0,001).
Мы поставили задачу провести сравнительный анализ зависимостей сочетанного воздействия изучаемых факторов с установлением приоритета каждого из них.
В качестве инструментального метода сравнения был использован многомерный регрессионный анализ. Тактика проведения анализа состояла в выявлении статистически значимых зависимостей каждого из изученных
показателей, установлении наиболее «отзывчивых» во влиянии изученных факторов и параметров.
Изучаемые факторы были разбиты на группы:
1. Группа антенатальных и интранатальных факторов:
а) факторы, отражающие соматическую патологию матери;
б) факторы, отражающие течение настоящей беременности;
в) факторы, отражающие период родов;
2. Группа факторов, относящихся к состоянию новорожденного:
а) параметры, характеризующие состояние ребенка при рождении;
б) параметры, характеризующие течение периода новорожденности;
в) параметры, характеризирующие заболеваемость ребенка в раннем
возрасте.
В ходе исследования взаимосвязи соматической патологии матери и сроков компенсации неврологических нарушений, установлено, что ни одно из заболеваний не оказывало значимого влияния на позднюю (после 1,5 лет) неврологическую компенсацию. Суммарный вклад этой группы факторов составил только 4,46% и явился статистически не значимым (р = 0,9308).
Исследуя влияние течения беременности у матери на сроки неврологической компенсации у детей, установлено, что ни один из изучаемых параметров по отдельности не влиял на позднее наступление неврологической компенсации, но в совокупности факторы, отражающие течение настоящей беременности, дали около 53% вклада с вероятностью статистической значимости 99% (р = 0,0000).
При анализе взаимосвязи периода родов и сроков неврологической компенсации у детей, было выявлено, что из всех осложнений интранатального периода только экстренное кесарево сечение влияет на позднюю компенсацию с вероятностью статистической значимости более 95% (р = 0,0401). Суммарный вклад интранатальных факторов составил 14,72% с вероятностью статистической значимости всего 85%.
Общий вклад параметров, характеризующих состояние ребенка при рождении, в позднее наступление неврологической компенсации у детей составил 34% (р = 0,0006). По отдельности ни один из факторов не влиял на сроки неврологической компенсации.
Изучая влияние течения неонатального периода на позднее наступление компенсации неврологических нарушений, выявлена сильная зависимость между сроками компенсации и степенью тяжести церебральной ишемии (р = 0,0486) и синдромом гипервозбудимости (р = 0,0159). Совокупный вклад всех факторов неонатальной заболеваемости составил 50%.
Совокупный вклад всех факторов неонатальной заболеваемости составил 50%.
Концентрация гемоглобина на первые (р = 0,0174) и пятые (р = 0,0078) сутки и количество эритроцитов на пятые сутки (р = 0,0315) влияют на сроки неврологической компенсации со статистической значимостью более 95%. Оценка суммарного воздействия этих параметров свидетельствует, что коэффициент детерминации равен 28% с вероятностью 99% (р = 0,0002).
Анализ влияния нейросонографических изменений головного мозга на сроки неврологической компенсации установил, что диффузные изменения тканей мозга гипоксически-ишемического характера (р = 0,0000), перивентрикулярный отек (р = 0,0202) и признаки ликвородинамических нарушений, сохраняющиеся после полугода жизни (р = 0,0001), влияют на позднее восстановление функций после неврологических нарушений у детей с вероятностью до 99%. В совокупности все нейросонографические изменения голоного мозга статистически значимо (р = 0,0000) влияют на время восстановления функций после неврологических нарушений с коэффициентом детерминации 53%.
Среди патологии детей в раннем возрасте значимо влияющим фактором на сроки неврологической компенсации явилась частота ОРВИ (р = 0,0115). Суммарный вклад заболеваемости детей в раннем возрасте в позднюю компенсацию составил 52%. Статистическая значимость сочетанного воздействия указанных факторов составляет 99% (р = 0,0000).
Исследование показателей эндотелина-1 у новорожденных, перенесших хроническую внутриутробную гипоксию
Концентрация ЭТ-1 была определена в крови у 53 новорожденных (41 ребенок основной группы и ¡2 детей группы сравнения). В ходе исследования дети основной группы, перенесшие ХВГП, были разделены на 2 подгруппы. В 1А подгруппу вошло 15 детей, которые в раннем неонатальном периоде не имели признаков гипоксически-ишемического поражения ЦНС. 1Б подгруппу составили 26 детей с признаками церебральной ишемии I и II степени в раннем неонатальном периоде.
На первом этапе исследования маркера эндотелиальной дисфункции у новорожденных был проведен подробный анализ соматической и гинекологической патологии матери, течение настоящей беременности и родов.
Средний возраст матерей в группах достоверно не отличался и составил в контрольной группе 27,75±3,98 лет, в 1А подгруппе — 28,60±5,96 лет, 1Б подгруппе — 27,12±5,64 лет. Анализ экстрагенитальной патологии матерей показал, что различий в общей заболеваемости в группах не обнаружено. В контрольной группе среди экстрагенитальной патологии расстройства вегетативной нервной системы встречались чаще, чем в группе «с ХВГП с церебральной ишемией» (р<0,05). В подгруппах детей с ХВГП преобладали хронический пиелонефрит и расстройства вегетативной нервной системы.
В гинекологическом анамнезе достоверных различий между группами также не выявлено. Во всех группах преобладали воспалительные болезни женских половых органов.
Течение беременности у матерей в группах детей с хронической гипоксией (1А и 1Б подгруппы) осложнилось гестозом второй половины у всех женщин, угрозой прерывания в 1А подгруппе — у одной трети и в 1Б
подгруппе — у половины женщин. В контрольной группе гестоз и угроза прерывания не регистрировались.
Наличие внутриутробного страдания плода подтверждалось проведением КТГ и ультразвуковых допплерометрических исследований. ПСП, частота встречаемости ФПН и маловодие в группах с хронической гипоксией было достоверно выше, чем в контрольной (р<0,001). В 1Б подгруппе выраженное страдание плода отмечалось более чем у половины женщин, тогда как в 1А только у трети обследуемых. В контрольной группе при кардиотокографическом исследовании патологии не выявлено. Допплерометрическое исследование показало наличие признаков ФПН в грушах с хронической гипоксией у всех женщин. В контрольной группе у половины беременных встречалась только 1а степень ФПН.
Течение интранатального периода в группах не отличалось. Путем самостоятельных родов было рождено более половины детей во всех группах. Аномалии родовой деятельности и патология пуповины осложнили течение родов у одной трети женщин в группах с ХВГП. Дородовое излитие околоплодных вод в группе «с ХВГП с церебральной ишемией» наблюдалось у каждой пятой женщины. В контрольной группе более половины самостоятельных родов протекали физиологически.
В контрольной группе более половины самостоятельных родов протекали физиологически.
Отсутствие достоверных различий в соматической и генитальной патологии у матерей, а также отличий по полу, сроку гестации, оценке по шкале Апгар у детей во всех исследуемых группах позволило нам провести сравнение показателей ЭТ-1 в подгруппах с ХВГП и оценить участие маркера эндотелиальной дисфункции в неонатальной заболеваемости. Для этого концентрация ЭТ-1 была определена у новорожденных в пуповинной крови и на 3-5 сутки (таблица 3).
Таблица 3
Содержание ЭТ-1 в плазме крови новорожденных сразу после рождения
и на 3-5 день жизни
Контрольная группа (п= 12) Основная группа (п=41)
1А(п=15) 1Б (п=26)
ЭТ-1 в плазме пуповинной крови, фмоль/мл 0,81±0,21 2,21±0,66* 1,93±0,87*
ЭТ-1 в плазме на 3-5 сутки, фмоль/мл 1,14±0,42 1,62*0,49″» 1,51*0,49*’
Примечание: * р<0,001 между контрольной группой и группами с ХВГП
*1 р<0,05 между контрольной группой и группами с ХВГП
При анализе полученных данных было выявлено достоверное повышение ЭТ-1 в пуповинной крови как в 1А подгруппе — 2,21±0,17 фмоль/мл, так и в 1Б — 1,93±0,17 фмоль/мл, по сравнению с контрольной группой (р<0,001). Определение уровня ЭТ-1 в крови новорожденных детей в период ранней неонатальной адаптации на 31-5 сутки показало, что произошло его незначительное снижение, но все-таки он оставался
достоверно повышен 1,62±0,16 фмоль/мл в 1А подгруппе и 1,51 ±0,11 фмоль/мл в 1Б, по сравнению с контрольной группой (р<0,05). Вероятно, повышение маркера эндотелиальной дисфункции явилось следствием постгипоксических нарушений у детей в ранний неонатальный период.
Соматическая патология в раннем неонатальном периоде в подгруппе 1Б встречалась чаще, чем в других группах. ЗВУР регистрировалась практически у половины новорожденных в подгруппе 1Б, каждый пятый перенес транзиторное тахипноэ, постгипоксическая кардиолатия и ВУИ были обнаружены по 15,4% случаев. В подгруппе без гипоксического поражения ЦНС были выявлены конъюгационная желтуха у пятой части детей и транзиторное тахипноэ в 13,3% случаев. В контрольной группе превалировали анемия, конъюгационная желтуха и транзиторное тахипноэ у детей рожденных путем кесарева сечения с одинаковой частотой (16,7%).
В подгруппе без гипоксического поражения ЦНС были выявлены конъюгационная желтуха у пятой части детей и транзиторное тахипноэ в 13,3% случаев. В контрольной группе превалировали анемия, конъюгационная желтуха и транзиторное тахипноэ у детей рожденных путем кесарева сечения с одинаковой частотой (16,7%).
Критерием включения детей в 1Б подгруппу явилась церебральная ишемия. 1 и II степень тяжести этой патологии встречалась одинаково часто. Синдром гипервозбудимости был определен ведущим и составил 65,4% случаев среди всех неврологических синдромов. Гипертензионный синдром и синдром угнетения регистрировались у пятой части детей, в меньшем проценте (11,5%) встречался синдром вегето-висцеральных дисфункций (рис.5). ________
О Синдром
гипс рвозбуди мости
И Синдром
■ Синдром всгето-висцеральных дисфункций Ш Гипертеизион мый синдром
Рис. 5 Клинические синдромы церебральной ишемии в подгруппе «с ХВГП с церебральной ишемией»
Для выявления участия ЭТ-1 в формировании гипоксического поражения ЦНС было прослежено дальнейшее развитие на первом году жизни у 28 детей.
Показатели физического развития к году у детей в контрольной группе и 1А подгруппе находились между 10 и 90 центилем. В подгруппе «с ХВГП с церебральной ишемией» практически половина детей (41,7%) имели окружность груди ниже 10 центиля, и только у одного ребенка значения роста к году были ниже 10 центиля. Окружность головы на первом году жизни в контрольной группе соответствовала 10-90 центилю у всех обследуемых. Увеличение размеров окружности головы в первом полугодии произошло на 6,9±0,83 см, что соответствовало возрастной норме. Темпы роста окружности головы в первом полугодии у детей основной группы (8,4±1,3 см и 9,2±1,9 см в 1А и 1Б подгруппах соответственно) достоверно выше, чем в контрольной группе (р<0,01).
Всем детям в возрасте 1 месяца проводилась нейросонография. В контрольной группе патологии не было выявлено.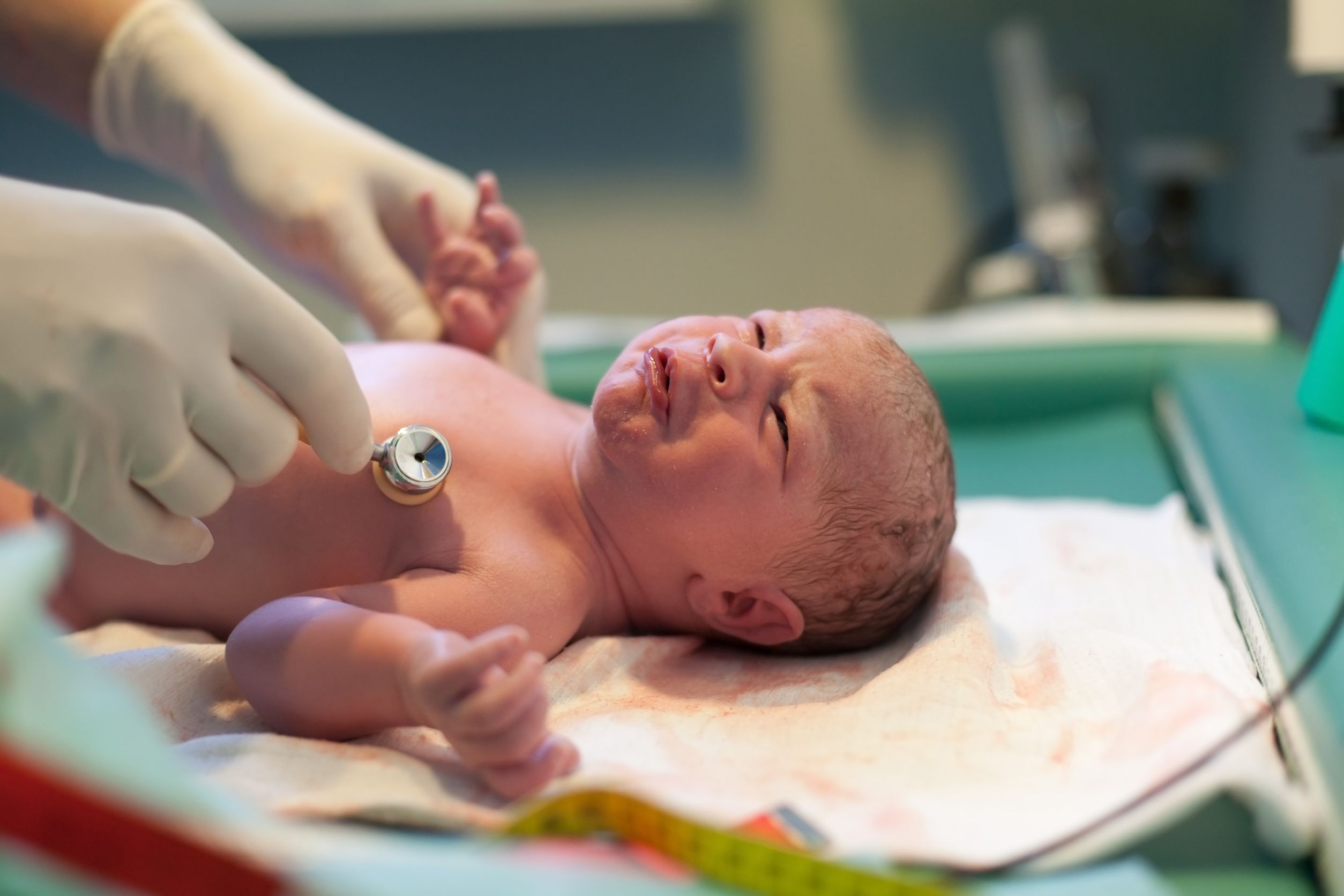 В подгруппе «с ХВГП без церебральной ишемии» на первое место выступали перивентрикулярный отек и диффузные изменения тканей мозга гипоксически-ишемического характера по 75% случаев. Эти же изменения в головном мозге у детей подгруппы «с ХВГП с церебральной ишемией» встречались также более чем у половины обследуемых. Более половины детей 1Б подгруппы имели признаки ликвородинамических нарушений, тогда как в 1А признаки нарушения ликвородинамики визуализированы в 37,5% случаев.
В подгруппе «с ХВГП без церебральной ишемии» на первое место выступали перивентрикулярный отек и диффузные изменения тканей мозга гипоксически-ишемического характера по 75% случаев. Эти же изменения в головном мозге у детей подгруппы «с ХВГП с церебральной ишемией» встречались также более чем у половины обследуемых. Более половины детей 1Б подгруппы имели признаки ликвородинамических нарушений, тогда как в 1А признаки нарушения ликвородинамики визуализированы в 37,5% случаев.
При неврологическом обследовании в 1А подгруппе клинические признаки последствий перинатального поражения ЦНС были обнаружены у всех детей, проявляющиеся у 75% нарушением моторного развития, у одной трети — сочетанными формами задержки развития. У половины обследуемых обнаружен гипертензионный синдром. В 1Б подгруппе последствия церебральной ишемии выявлены у 9 пациентов (75%). Среди неврологической патологии в этой подгруппе превалировали сочетанные формы задержки развития (66,7%). Нарушения моторного развития и гипертензионный синдром встречались с одинаковой частотой (по 58,3%)
Рис. 6 Неврологическая патология у детей на первом году жизни
Нужно отметить, что неврологическая патология наблюдалась в группах с ХВГП у детей, Которые имели в раннем неонатальном периоде уровень ЭТ-1 выше, чем максимальное значение у детей в контрольной группе (1,1 фмоль/мл) (рис. 7).
I □ частоте
встречаемости последствий иереребральной ишемии
концентрация ЭТ-1 в пуповинной крови, фмоль/мл
Рис. 7 Частота встречаемости последствий
церебральной ишемии в зависимости от концентрации эндотелина-1
Учитывая, что симптомокомплекс при таких нозологических формах, как нарушение моторного развития и сочетанные формы задержки развития имеет диагностическое значение при исключении других причин, был проведен анализ соматической патологии. Во всех группах на первое место выступали ОРВИ от 62,5% до 83,3%, но в группу часто болеющих не был включен ни один ребенок. У одной трети детей основной группы встречалась анемия, у четверти пациентов — дисбиоз кишечника и атопический дерматит. В контрольной группе процент соматической патологии был ниже, однако, достоверных отличий в заболеваемости детей контрольной и основной групп выявлено не было.
У одной трети детей основной группы встречалась анемия, у четверти пациентов — дисбиоз кишечника и атопический дерматит. В контрольной группе процент соматической патологии был ниже, однако, достоверных отличий в заболеваемости детей контрольной и основной групп выявлено не было.
При проведении корреляционного анализа обнаружена прямая взаимосвязь концентрации эндотелина-1 в пуповинной крови с хроническим пиелонефритом у матери с коэффициентом корреляции г = 0,6 (р<0,001), гестозом г = 0,55 (р<0,001), инфекционными заболеваниями матери во время беременности г = 0,65 (р<0,001), концентрацией гемоглобина г = 0,67 (р<0,001) и количеством эритроцитов г = 0,59 (р<0,001) у новорожденных в крови на 1-е сутки. Статистически значимо с концентрацией ЭТ-1 в период ранней неонатальной адаптации связаны многоводие г = 0,58 (р<0,001), кардиотокографические признаками страдания плода г = 0,67 (р<0,001), ВУИ г = 0,58 (р<0,001). Проведенный корреляционный анализ выявил также прямую зависимость между концентрацией эндотелина-1 в пуповинной крови и на 3-5 сутки и диффузными изменениями тканей мозга гипоксически-ишемического характера с коэффициентом корреляции г =
0.67 (р<0,001) и г = 0,56 (р<0,001), сочетанными формами задержки развития г = 0,53 (р<0,001) и г = 0,74 (р<0,0001), нарушением моторного развития г = 0,59 (р<0,001) и г = 0,58 (р<0,001) соответственно. Доброкачественная внутричерепная гипертензия коррелирует только с концентрацией ЭТ-1 на 3-5 сутки г = 0,67 (р<0,001).
На основании изложенного выше, можно сделать вывод, что дети, перенесшие хроническую внутриутробную гипоксию, имеют повышенные показатели ЭТ-1 как в плазме пуповинной крови, так и в плазме крови на 35 сутки. Увеличение уровня ЭТ-1 в крови сохраняется независимо от наличия клинических проявлений, что говорит о сохраняющихся в организме новорожденного постгипоксических нарушениях и о развитии эндотелиальной дисфункции, что впоследствии приводит к неврологическим нарушениям на первом году жизки.
ВЫВОДЫ
1. В раннем неонатальном периоде у трети детей с ХВГП в сочетании и без асфиксии встречалась ЗВУР. У новорожденных, перенесших асфиксию острую или на фоне ХВГП, преобладали дыхательные, сердечно-сосудистые нарушения и ВЖК гипоксического генеза. Наименьший процент
церебральной ишемии приходился на детей, перенесших только хроническую гипоксию.
2. Дисгармоничное физическое развитие с избытком массы тела у детей, перенесших острую и хроническую гипоксию, к году составило от 15% до 50%. Более половины детей с ХВГП в возрасте одного года имели узкую грудную клетку. Только у половины детей с ХВГП в сочетании и без асфиксии окружность головы соответствовала возрастным нормативам. Гармоничное физическое развитие к трем годам реже встречалось у детей, перенесших только ХВГП.
3. При анализе соматической заболеваемости установлено, что от 20% до 30% детей, перенесших острую, хроническую или сочетанную гипоксию, относятся к группе часто болеющих. Анемия, дисбиоз кишечника и атопический дерматит являются преобладающими в структуре заболеваемости.
4. В структуре неврологической заболеваемости на первом году жизни превалировали доброкачественная внутричерепная гипертензия, а к 3-м годам нарушения развития речи и гиперкинетические расстройства. Дети, перенесшие умеренную острую асфиксию, достигли компенсации неврологических нарушений к году, а дети с ХВГП, к 3-м годам. У пятой части детей с тяжелой асфиксией и у одной трети детей с умеренной асфиксией, развившихся на фоне ХВГП, компенсация неврологических нарушений к 3-м годам не наступила. Частота развития ДЦП составила 5,6%.
5. При изучении факторов риска поздней (после 1,5 лет) неврологической компенсации установлено, что наиболее высокая доля вклада принадлежит течению настоящей беременности, патологическим изменениям в головном мозге при нейросонографии и заболеваемости детей в течение 3-х лет (коэффициент детерминации = 53%). Суммарная доля неонатальной заболеваемости составила 50% вклада, а состояние ребенка при рождении -34% вклада.
6. Показатели ЭТ-1 у детей, перенесших хроническую внутриутробную гипоксию, являются повышенными как в пуповинной крови, так и на 3-5 сутки. У детей с ХВГП, имеющих уровень ЭТ-1 в пуповинной крови выше, чем максимальное значение у детей в контрольной группе развиваются неврологические нарушения на первом году жизни. Таким образом, ЭТ-1 можно считать маркером хронической внутриутробной гипоксии, имеющим прогностическое значение в развитии неврологических нарушений.
ПРАКТИЧЕСКИЕ РЕКОМЕНД АЦИИ
1. Для прогнозирования сроков компенсации неврологических расстройств у детей с перинатальной гипоксией (при условии стандартных методов лечения) необходима комплексная оценка группы факторов, включающих антенатальное развитие и интранатальный период, неонатальную заболеваемость и данные нейросонографии, заболеваемость на протяжении первых 3-х лет. Обследование и
наблюдение детей, перенесших перинатальную гипоксию, должно включать в себя оценку физического развития с обязательным ежемесячным определением окружностей головы и груди на протяжении 1-1,5 лет, оценку неврологического и соматического статуса, обязательное проведение нейросонографии всем детям в первом полугодии жизни не менее 2-х раз, даже при отсутствии патологии при предыдущем исследовании. Данный комплекс обследования позволяет выявить в более ранние сроки наличие соматических и неврологических расстройств, а также способствует определению «клинически немых» форм поражения головного мозга, что определяет своевременную коррекцию выявленных нарушений.
2. Рекомендовано внедрить в практическую медицину определение концентрации ЭТ-1 в плазме пуповинной крови у детей с высоким риском хронической внутриутробной гипоксии для выявления наличия постгипоксических нарушений и раннего прогнозирования развития последствий перинатального поражения ЦНС у детей на первом году жизни.
Список работ опубликованных по теме диссертации:
1. Катамнез детей, перенесших тяжелую асфиксию в родах У O. A. Дрожжина, Л.И. Ипполитова, С.Л. Хачатурян, A.M. Якунинская, Е.В. Минакова // Пути повышения эффективности медицинской помощи детям: материалы X конгресса педиатров России. — М., 2006. — С. 186.
A. Дрожжина, Л.И. Ипполитова, С.Л. Хачатурян, A.M. Якунинская, Е.В. Минакова // Пути повышения эффективности медицинской помощи детям: материалы X конгресса педиатров России. — М., 2006. — С. 186.
2. Физическое развитие и заболеваемость детей, перенесших тяжелую асфиксию в родах / O.A. Дрожжина, Л.И. Ипполитова, С.Л. Хачатурян, А.М, Якунинская, Е.В. Минакова // Сборник материалов 5 Всероссийской университетской научно-практической конференции молодых ученых и студентов по медицине. — Тула, 2006. — С. 88 — 89.
3. Оценка физического развития и структуры заболеваемости детей, перенесших тяжелую асфиксию в родах / O.A. Дрожжина, Л.И. Ипполитова, С.Л. Хачатурян, A.M. Якунинская, Е.В. Минакова // Перспективы и пути развития неотложной педиатрии: материалы ежегодной междисциплинарной научно-практической конференции стран СНГ. — Санкт-Петербург, 2006. — С. 69 — 70.
4. Дрожжина O.A. Развитие и структура заболеваемости детей, перенесших тяжелую асфиксию / O.A. Дрожжина // Новые технологии в перинатологии: материалы ежегодного конгресса специалистов перинатальной медицины. — М., 2006. — С. 22.
5. Пронина O.A. Катамнез развития детей, перенесших тяжелую асфиксию интранатально / O.A. Пронина, И.И. Логвинова // Сборник материалов VI Всероссийской университетской научно-практической конференции молодых ученых и студентов по медицине. — Тула, 2007. — С. 204 — 205.
6. Пронина O.A. Исследование показателей эндотелина-1 у новорожденных детей, перенесших хроническую внутриутробную гипоксию / O.A.
Пронина // Системный анализ и управление в биомедицинских системах. — 2008. — Т 7, № 3. — С. 691 — 693.
7. Эндотелии-1 — маркер внутриутробной гипоксии у новорожденных детей / O.A. Пронина, И.И. Логвинова, Л.И. Ипполитова, Л.П. Лободина, Н.П. Стасенкова // Вестник Российского государственного медицинского университета. — 2008. — № 4 (63). — С. 164.
8. Концентрация плазменного эндотелина у новорожденных с перинатальным гипоксическим поражением центральной нервной системы / O. A. Пронина, И.И. Логвинова, М.В. Сулина, Т.Г. Чистотинова, Е.В. Трухачева, Н.В. Заяц // Актуальные вопросы организации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара: материалы II научно-практической конференции, посвященной 130-летию родильного дома ГКБСМП № 10. — Воронеж, 2008. — С. 54 — 57.
A. Пронина, И.И. Логвинова, М.В. Сулина, Т.Г. Чистотинова, Е.В. Трухачева, Н.В. Заяц // Актуальные вопросы организации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара: материалы II научно-практической конференции, посвященной 130-летию родильного дома ГКБСМП № 10. — Воронеж, 2008. — С. 54 — 57.
9. Пронина O.A. Эндотелиальная дисфункция у новорожденных детей, перенесших хроническую внутриутробную гипоксию / O.A. Пронина, И.И. Логвинова // Современная перинатология: организация, технологии и качество: материалы 3 ежегодного конгресса 6 съезда Российской ассоциации специалистов перинатальной медицины. — 2008. — С. 43.
10. Роль эндотелина-1 в развитии церебральной ишемии у новорожденных / О.А, Пронина, И.И. Логвинова, Л.П. Лободина, Н.П. Стасенкова, Т.Г. Чистотинова // Современные технологии в педиатрии и детской хирургии: материалы VII Российского конгресса. — 2008. — С. 198 — 199.
СПИСОК СОКРАЩЕНИЙ
ВЖК — внутрижелудочковое кровоизлияние ВУИ — внутриутробная инфекция ДЦП — детский церебральный паралич ЗВУР — задержка внутриутробного развития КТГ — кардиотокография
ОРВИ — острая респираторная вирусная инфекция
ПСП — показатель состояния плода
ФПН — фето-плацентарная недостаточность
ХВГП — хроническая внутриутробная гипоксия плода
ЦНС — центральная нервная система
ЭТ — эндотелии
Подписано в печать 15.04.2009 г. Формат 60 х 84/16 . Бумага офсетная. Усл. печ. л. 1,4 Тираж 101 экз. Заказ № 1162
Отпечатано в типографии Воронежский ЦНТИ-филиал ФГУ «Объединение «Росинформресурс» Минпромэнерго России
394730, г. Воронеж, пр. Революции, 30
Недостаток кислорода не убивает клетки мозга младенца — ScienceDaily
Ежегодно во всем мире почти 15 миллионов детей рождаются преждевременно или до 37 недель беременности. Когда ребенок рождается слишком рано, незрелый дыхательный центр в мозге ребенка часто не может дать ему сигнал дышать, что приводит к низкому уровню кислорода или гипоксии в мозгу.
Исследования, опубликованные в журнале Journal of Neuroscience , показывают, что даже короткого 30-минутного периода гипоксии достаточно, чтобы постоянно нарушать структуру и функцию области мозга, известной как гиппокамп, которая имеет жизненно важное значение для обучения и памяти.
«Наши результаты вызывают новые опасения по поводу уязвимости мозга недоношенных к гипоксии. Они касаются долгосрочного воздействия кислородного голодания на способность этих недоношенных детей учиться по мере их взросления и школьного возраста», сказал главный исследователь исследования Стивен Бэк, доктор медицины, доктор философии, Клайд и Эльда Мансон, профессор педиатрических исследований и педиатрии, Медицинская школа OHSU, Детская больница OHSU Doernbecher.
В отделении интенсивной терапии новорожденных недоношенные могут испытывать до 600 коротких, но тяжелых периодов гипоксии каждую неделю.Следовательно, более одной трети детей, переживших преждевременные роды, вероятно, будут иметь меньший мозг, предположительно из-за потери клеток мозга, по сравнению с мозгом доношенных детей. Это может увеличить риск серьезных проблем нервного развития на протяжении всей жизни, которые повлияют на обучение, память, внимание и поведение.
Используя модель двойного недоношенного плода овцы, Бэк и его коллеги изучили влияние гипоксии в отдельности, а также в сочетании с ишемией — или недостаточным кровотоком — на развивающийся гиппокамп.Результаты подтверждают, что, как и у недоношенных людей, рост гиппокампа нарушен. Однако клетки мозга не умирают, как считалось ранее. Скорее, клетки гиппокампа не могут нормально созревать, вызывая снижение долгосрочной потенциации или клеточной основы того, как мозг обучается.
Примечательно, что тяжесть гипоксии предсказала степень, в которой клетки гиппокампа не смогли нормально созреть, объясняет Бэк. Эти данные тем более неожиданны, что не было оценено, что недоношенный гиппокамп уже был способен к этим процессам обучения.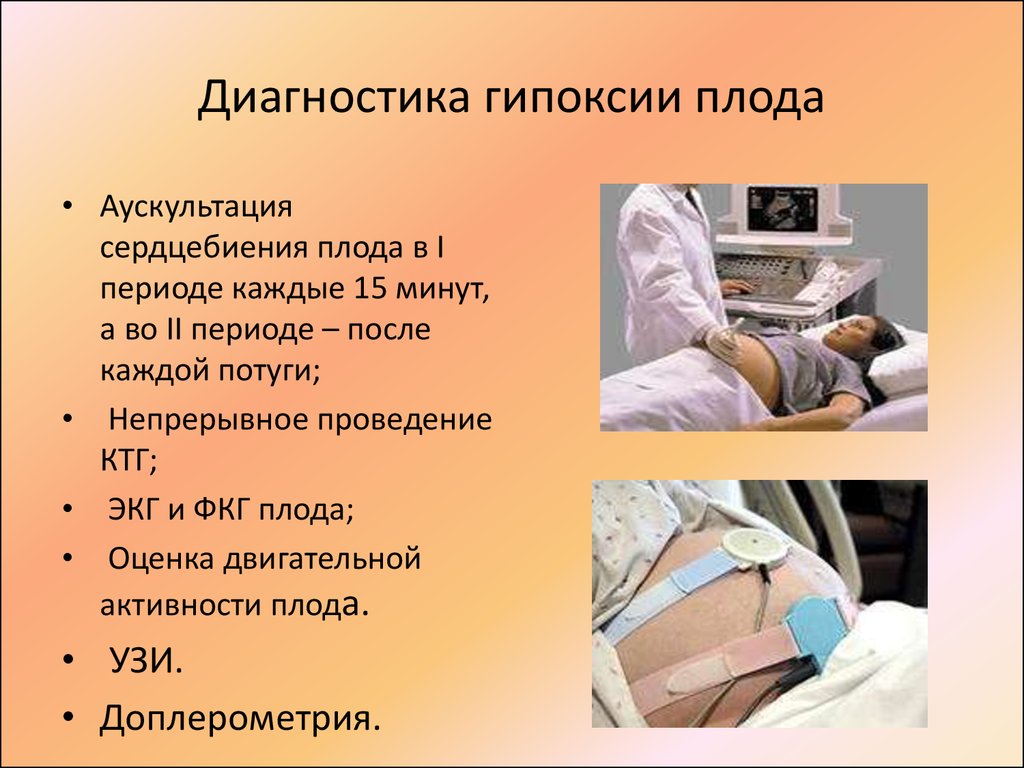
«Далее мы хотим понять, как очень короткое или продолжительное воздействие гипоксии влияет на способность к оптимальному обучению и памяти», — говорит Бэк. «Это позволит нам понять, как гиппокамп реагирует на недостаток кислорода, создавая новые механизмы ухода и вмешательства как в больнице, так и дома».
История Источник:
Материалы предоставлены Орегонским университетом здравоохранения и науки . Примечание. Содержимое можно редактировать по стилю и длине.
Легкая нехватка кислорода при рождении может иметь серьезные долгосрочные последствия
Специалистам давно известно, что младенцы могут получить длительные травмы, если им не хватает кислорода при рождении. Исследование, проведенное в Ирландии, показывает, что даже незначительное кислородное голодание повышает риск задержки развития и может иметь долгосрочные последствия для младенцев.
В исследовании, проведенном Университетским колледжем в Корке, участвовало 60 младенцев, перенесших гипоксически-ишемическую энцефалопатию, или ГИЭ, состояние, при котором мозг ребенка не получает достаточно кислорода во время рождения.
Врачи записали мозговые волны младенцев при рождении и в течение следующих пяти лет. Они обнаружили, что у детей, перенесших как умеренную, так и легкую ГИЭ, часто наблюдались незначительные нарушения обучаемости. Около 18-20 процентов детей, перенесших легкую ГИЭ при рождении, имели трудности в обучении или поведении в возрасте пяти лет, включая задержку речи, аутизм, синдром дефицита внимания и диспраксию. Кроме того, средние и легкие случаи ГИЭ были связаны с общими более низкими показателями IQ, плохой памятью и сниженной скоростью обработки.
Если ваш ребенок получил предотвратимую травму во время родов из-за халатности врача или медсестры, наши поверенные по вопросам медицинской халатности могут помочь. Свяжитесь с нами как можно скорее.
Рекомендации по лечению
В настоящее время младенцев с умеренным ГИЭ лечат терапевтической гипотермией, также известной как охлаждающая камера. В камере используется специальная шапочка, одеяло или матрас, чтобы снизить температуру тела новорожденного до 89,6 градусов по Фаренгейту в течение 72 часов после рождения.Младенцев, страдающих легким ГИЭ, обычно не помещают в охлаждающую камеру.
В камере используется специальная шапочка, одеяло или матрас, чтобы снизить температуру тела новорожденного до 89,6 градусов по Фаренгейту в течение 72 часов после рождения.Младенцев, страдающих легким ГИЭ, обычно не помещают в охлаждающую камеру.
Авторы исследования считают, что некоторым детям, страдающим легким ГИЭ, может помочь лечение в охлаждающей камере или повторное наблюдение и оценка в раннем детстве.
Чтобы получить бесплатную юридическую консультацию, позвоните по телефону 516-358-6900
Причины кислородной недостаточности при рождении
По оценкам Американского колледжа акушеров и гинекологов, четыре процента младенцев страдают от недостатка кислорода при рождении, хотя некоторые исследования установили, что число достигает 23 процентов.Недостаток кислорода у ребенка может быть вызван многими факторами. Вот некоторые из наиболее распространенных:
- Недостаточно кислорода в крови матери
- Плацента слишком быстро отделяется от матки
- Инфекция
- Проблемы с пуповиной во время родов, например выпадение пуповины или пуповины вокруг матки. шея ребенка
- Очень долгие или тяжелые роды
- Дыхательные пути ребенка заблокированы
- У матери высокое или низкое кровяное давление.
- Халатность или ошибка со стороны врачей или персонала больницы в том, что они не смогли предвидеть осложнения при родах
Последствия кислородной недостаточности
Длительные последствия недостатка кислорода («рожденный синим») зависят от того, как долго ребенок был без кислорода и как быстро было начато лечение. Младенцы могут сразу же пострадать от повреждения клеток. Дополнительный ущерб может возникнуть из-за токсинов, выделяемых из поврежденных клеток после восстановления притока кислорода и крови к мозгу.
Недостаток кислорода может вызвать различные родовые травмы и заболевания, в том числе:
- Детский церебральный паралич
- Нарушение развития
- Синдром дефицита внимания
- Нарушение зрения
- Постоянное повреждение головного мозга, сердца, легких или других органов
Если ваш ребенок получил родовую травму, важно понять причину и было ли это травмой, которую можно предотвратить. Если врач или персонал больницы вызвали травму или способствовали ей, поверенный по родовой травме на Лонг-Айленде сможет помочь вам вернуть деньги, которые помогут покрыть расходы на лечение и уход за вашим ребенком.Свяжитесь с нами сегодня.
Если врач или персонал больницы вызвали травму или способствовали ей, поверенный по родовой травме на Лонг-Айленде сможет помочь вам вернуть деньги, которые помогут покрыть расходы на лечение и уход за вашим ребенком.Свяжитесь с нами сегодня.
Позвоните или отправьте текстовое сообщение 516-358-6900 или заполните бесплатную форму оценки случая
Перинатальная гипоксия — причины и осложнения во время родов
С научной точки зрения, перинатальный означает непосредственно до и после рождения, в то время как гипоксия означает кислородное голодание в тканях. Таким образом, перинатальную гипоксию можно напрямую интерпретировать как дефицит кислорода в тканях непосредственно до и после рождения. Однако интерпретация дает только обзор степени медицинских осложнений, возникающих в результате перинатальной гипоксии.В некоторых случаях ребенок может перестать дышать в результате родовых осложнений. В таких условиях недостаток кислорода в мозге приводит к гибели некоторых клеток мозга, что, в свою очередь, может вызвать церебральный паралич.
Причина перинатальной гипоксии
Есть несколько причин, по которым младенцу может не хватать кислорода до и после рождения. Некоторые из основных причин перинатальной гипоксии включают:
- Материнская анемия
- Асфиксия при рождении
- Отсутствие адекватного мониторинга плода
- Курение матери
- Травматические повреждения головного мозга
- Отслойка плаценты
Вышеуказанные состояния могут быть диагностированы медицинским работником, чтобы снизить факторы риска, связанные с перинатальной гипоксией.Отсутствие надлежащей оценки и мониторинга может привести к осложнениям при родах и возникновению экстренного кесарева сечения.
Последствия перинатальной гипоксии
Перинатальная гипоксия может привести к серьезным медицинским осложнениям у младенцев, которые в противном случае могут повлиять на всю жизнь младенца или даже вызвать смерть. Одним из основных последствий перинатальной гипоксии является серьезное повреждение головного мозга, которое может вызвать паралич всего тела. Младенец с перинатальной гипоксией, вероятно, испытает полный эффект гипоксии, включая травмы мозга, через 48 часов после рождения.Это означает, что эффект перинатальной гипоксии можно свести к минимуму, если разрешить ситуацию в первые 48 часов после рождения. Записи Национального института здравоохранения США показывают, что перинатальная гипоксия является причиной примерно 1/3 неонатальных смертей.
Одним из основных последствий перинатальной гипоксии является серьезное повреждение головного мозга, которое может вызвать паралич всего тела. Младенец с перинатальной гипоксией, вероятно, испытает полный эффект гипоксии, включая травмы мозга, через 48 часов после рождения.Это означает, что эффект перинатальной гипоксии можно свести к минимуму, если разрешить ситуацию в первые 48 часов после рождения. Записи Национального института здравоохранения США показывают, что перинатальная гипоксия является причиной примерно 1/3 неонатальных смертей.
Перинатальная гипоксия также может вызывать другие медицинские осложнения, такие как:
- Тяжелые судороги
- Детский церебральный паралич
- Инвалидность
- Расстройство поведения
Лечение перинатальной гипоксии
Когда упоминается слово переохлаждение, первое, что приходит в голову, — это замерзание.Однако гипотермия является частью медицинского процесса, используемого при лечении перинатальной гипоксии, известной как неонатальная терапевтическая гипотермия. Неонатальная терапевтическая гипотермия — это относительно новый метод лечения, направленный на снижение риска тяжелого повреждения головного мозга у младенцев, а также на замедление развития перинатальной гипоксии.
Как работает терапевтическая гипотермия новорожденных
Предыдущие исследования установили, что когда люди получают травмы, они быстрее заживают, если травма произошла, когда тело было холодным.Эта концепция дала исследователям и врачам идею помещать младенцев с перинатальной гипоксией в условия пониженной температуры. При лечении неонатальной терапевтической гипотермией необходимо подчеркнуть некоторую срочность лечения, поскольку клетки мозга начинают умирать из-за недостатка кислорода через несколько минут. Статистические данные Национального института здоровья показывают, что примерно 6 из 1000 младенцев страдают перинатальной гипоксией. Таким младенцам грозит не только серьезное повреждение головного мозга, но и смерть. При неонатальной терапевтической гипотермии младенцев с перинатальной гипоксией помещают в температуру около 33 ° C примерно на 3 дня. Клинические условия и ресурсы, доступные в больнице, во многом определяют выживаемость и степень травм ребенка.
При неонатальной терапевтической гипотермии младенцев с перинатальной гипоксией помещают в температуру около 33 ° C примерно на 3 дня. Клинические условия и ресурсы, доступные в больнице, во многом определяют выживаемость и степень травм ребенка.
Заключение эксперта по терапевтической гипотермии новорожденных
Экспертное заключение о терапевтической гипотермии новорожденных указывает на то, что это лечение очень эффективно, когда речь идет о сокращении серьезных повреждений головного мозга. Однако до сих пор нет однозначных ответов относительно того, как работает неонатальная терапевтическая гипотермия.
Признаки того, что младенцу требуется неонатальная терапевтическая гипотермия
После рождения ребенка появляется несколько настораживающих признаков, которые могут потребовать лечения неонатальной терапевтической гипотермией, связанной с перинатальной гипоксией. Некоторые из знаков включают:
- Аномалии сердца
- Преждевременные роды
- Отсроченное кесарево сечение
- Дефицит кислорода у матери до рождения
- Анемия плода
- Осложнения пуповины
- Проблемная доставка
- Преэклампсия у матери
Факторы риска терапевтической гипотермии новорожденных
Причина, по которой неонатальная терапевтическая гипотермия рекомендуется в качестве альтернативного метода лечения перинатальной гипоксии, заключается в том, что польза от этой лечебной процедуры перевешивает риски.Однако это не означает, что с процессом не связаны факторы риска. Недавние исследования показывают, что терапевтическая гипотермия новорожденных увеличивает базовую частоту сердечных сокращений у младенцев, которые проходят медицинскую процедуру.
ГИЭ — гипоксическая ишемическая энцефалопатия
Перинатальная гипоксически-ишемическая энцефалопатия (ГИЭ) — один из наиболее серьезных и опасных для жизни типов повреждения головного мозга младенцев, которое может произойти во время родов.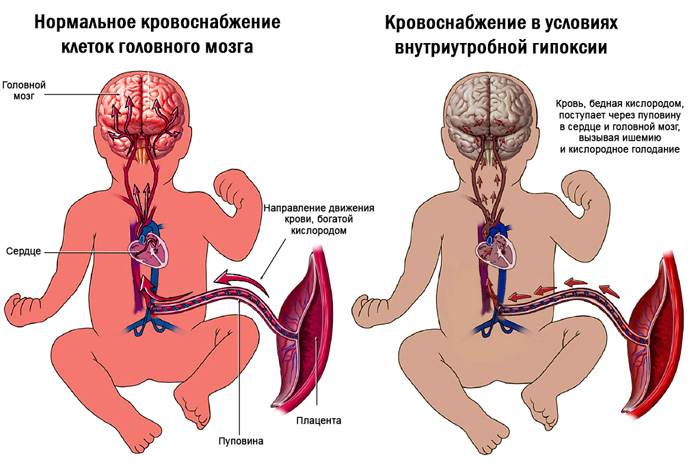 ГИЭ возникает, когда поступление кислорода и крови в мозг ребенка ограничено или прервано во время родов (перинатальная асфиксия), что приводит к гибели клеток мозга через короткие промежутки времени.
ГИЭ возникает, когда поступление кислорода и крови в мозг ребенка ограничено или прервано во время родов (перинатальная асфиксия), что приводит к гибели клеток мозга через короткие промежутки времени.
ГИЭ — это очень серьезный тип повреждения мозга младенца, который возникает во время родов, когда мозг ребенка лишен крови и кислорода. Из-за недостатка крови и кислорода клетки головного мозга ребенка умирают в считанные минуты.
Энцефалопатия — это медицинское слово, которое используется для обозначения различных родственных состояний, возникающих в результате травмы головного мозга. Гипоксическая ишемическая энцефалопатия (ГИЭ) — это особый тип повреждения головного мозга, вызванный комбинацией (1) гипоксии — нарушения циркуляции кислорода; и (2) ишемия — ограничение кровотока.Перинатальный ГИЭ возникает, когда кровь и кислород, поступающие в мозг, одновременно снижаются или прекращаются во время родов или сразу после них. ГИЭ — относительно редкое событие, которое происходит примерно у 3 из 1000 рождений.
Что вызывает гипоксическую ишемическую энцефалопатию (ГИЭ)?ГИЭ вызывается острой потерей притока крови и кислорода к мозгу ребенка во время родов или во время беременности. Недостаток кислорода и крови приводит к тому, что клетки развивающегося мозга ребенка быстро разлагаются, а затем умирают.Кислородная недостаточность, вызывающая ГИЭ, обычно вызвана акушерскими осложнениями во время родов и родоразрешения, но также может быть результатом пренатальных осложнений или событий. Осложнения, которые могут вызвать ГИЭ, включают:
Роды и Осложнения при родах:
Осложнения новорожденных:
Последствия ГИЭГИЭ — чрезвычайно серьезный тип черепно-мозговой травмы. Несмотря на то, что это происходит менее чем в 0,05% всех рождений, ГИЭ является одной из основных причин младенческой смертности в США.С. каждый год.
Помимо опасности для жизни, ГИЭ вызывает необратимое повреждение головного мозга. Примерно 15-20% новорожденных с диагнозом ГИЭ умрут в первую неделю. Из оставшихся выживших 25% получат необратимые повреждения головного мозга различной степени тяжести. Повреждения головного мозга в результате ГИЭ часто приводят к физическим недостаткам и когнитивным нарушениям.
У меньшего процента детей с ГИЭ хорошие результаты. Эти дети полностью выздоравливают и испытывают лишь легкие симптомы неврологической травмы, если таковые имеются.Нет данных о продолжительности жизни 80-85% детей с ГИЭ, как выживают в первую неделю жизни. Но очевидно, что в тяжелых случаях это влияет на прогнозируемую продолжительность жизни.
Симптомы ГИЭСимптомы ГИЭ сразу после рождения будут существенно различаться в зависимости, главным образом, от тяжести основного повреждения головного мозга:
Легкая ГИЭ
- Сухожильные рефлексы ненормальны, и мышцы жесткие в первые несколько дней
- Сильная раздражительность, проблемы с кормлением, чрезмерный плач или сон
- Симптомы легкой ГИЭ часто проходят в течение нескольких недель
Умеренная ГИЭ
- Недостаток мышечного тонуса (синдром гибкого ребенка) с отсутствием рефлексов
- Невозможно схватка и плохой сосательный рефлекс
- Спорадическое апноэ
- Припадки (обычно в течение первого дня)
Тяжелая ГИЭ
- Экстремальные приступы, которые учащаются в первые 2 дня
- Не реагируют на внешние раздражители
- Нерегулярное дыхание
- Крайняя гипотония (как тряпичная кукла)
- Abn нормальный контроль глаз или движение с расширенными зрачками
- Аномальная частота сердечных сокращений и артериальное давление
- Кардиореспираторная недостаточность (часто со смертельным исходом)
Основным методом лечения ГИЭ, набирающим обороты в последние годы, является охлаждение тела и головы.Это лечение обычно называют терапевтическим переохлаждением. Лечебная гипотермия направлена на снижение температуры тела ребенка ниже нормы сразу после рождения. Это эффективно замедляет процессы распада и повреждения клеток в головном мозге. Замедляя этот процесс, терапия гипотермии направлена на минимизацию долгосрочного воздействия ГИЭ. К сожалению, повреждение головного мозга от гипоксии новорожденных является постоянным и не может быть просто исправлено хирургическим вмешательством или лекарствами. Итак, ОТО — это необратимая травма.Варианты лечения включают терапию и лекарства, которые помогают справиться с последствиями любого повреждения головного мозга. Младенцы с тяжелыми травмами ГИЭ часто нуждаются в пожизненной поддержке и приспособлении.
Но есть и удивительные истории выздоровления от ГИЭ, когда ребенок получил необратимую травму с фантастическим исходом. Истории успеха после HIE не редкость. В конце концов, масштабы травмы ребенка, а это не утешение для родителей, часто не до конца понимают, пока ребенок не станет намного старше.
Научные источники
Йылдыз и др. «Неонатальная гипоксическая ишемическая энцефалопатия: обновленная информация о патогенезе заболевания и лечении». Экспертный обзор нейротерапии 17.5 (2017): 449-459.
Моллой, Элеонора Дж. И Синтия Биэр. «Неонатальная энцефалопатия против гипоксически-ишемической энцефалопатии». (2018): 574-574.
Finder, Mikael, et al. «Двухлетние исходы развития нервной системы после легкой гипоксической ишемической энцефалопатии в эпоху терапевтического гипотермии.» JAMA pediatrics 174.1 (2020): 48-55.
Greco, P., et al.» Патофизиология гипоксически-ишемической энцефалопатии: обзор прошлого и взгляд в будущее «. Acta Neurologica Belgica 120.2 (2020): 277-288.
Часто задаваемые вопросы о церебральном параличе | Какое влияние оказывает гипоксическая ишемическая энцефалопатия или кислородное голодание на новорожденного ребенка?
Что такое гипоксическая ишемическая энцефалопатия?Гипоксическая ишемическая энцефалопатия так называемое кислородное голодание — это повреждение головного мозга, вызванное нехваткой кислорода, поступающего в мозг новорожденного.Это состояние также известно как асфиксия во время родов, и оно может иметь краткосрочные и долгосрочные последствия для ребенка.
Что вызывает гипоксическую ишемическую энцефалопатию?К кислородной недостаточности у ребенка могут привести несколько факторов. Большинство из этих факторов возникает во время родов. Некоторые из причин кислородного голодания во время родов:
- Травмы пуповины
- Выпадение пуповины
- Избыточное давление в голове новорожденного
- Нарушение или снижение кровотока у ребенка
- Кровоизлияние
- Стресс во время родов и родоразрешения
- Медицинская халатность или халатность
Гипоксическая ишемическая энцефалопатия также может развиваться внутренне во время беременности, в основном из-за факторов окружающей среды или существующих условий с матерью.Вот некоторые из этих причин:
- Высокое или низкое кровяное давление у матери
- Свертывание крови у матери
- Проблемы с сердцем
- Инфекции, такие как воспалительные заболевания органов малого таза
- Потребление наркотиков и алкоголя
Воздействие кислородного голодания на ребенка может проявляться не сразу или может проявляться с разной скоростью в зависимости от тяжести травмы и пораженных участков головного мозга.Некоторые из краткосрочных последствий травмы для ребенка:
- Нерегулярная частота сердечных сокращений
- Припадки, особенно в течение первого дня жизни
- Апноэ, при котором ребенок задерживает дыхание на долгое время
- Задержка или отсутствие рефлексы
- Бледный цвет кожи
- Слабый мышечный тонус
- Проблемы с приемом пищи или кормлением грудью
Эти признаки могут помочь медицинским работникам поставить диагноз, чтобы определить, страдает ли ребенок гипоксической ишемической энцефалопатией, тем самым побуждая к дополнительным тестам, наблюдениям и лечению.Кроме того, врачи могут диагностировать кислородную недостаточность из-за низкого pH пуповины, что является признаком избытка кислоты и недостатка кислорода.
Каковы долгосрочные эффекты гипоксической ишемической энцефалопатии на ребенка?Долгосрочные эффекты кислородной недостаточности проявляются со временем и варьируются от легкого, умеренного до тяжелого. Длительные и постоянные условия, создаваемые гипоксической ишемической энцефалопатией, включают, но не ограничиваются ими:
- Детский церебральный паралич.Наиболее распространенное состояние, связанное с кислородным голоданием, которое ухудшает моторику или функцию.
- Инсульт плода
- Нарушения и задержка речи
- Поведенческие проблемы
- Постоянная боль
- Когнитивный дефицит
- Внутричерепные кровоизлияния
- Ортопедические состояния
- Эпилепсия и судороги
Эти эффекты неизлечимы, но есть несколько методов лечения, методы лечения и системы поддержки, которые могут облегчить симптомы и немедленные последствия состояний.
Какие варианты лечения?Лечение состояний и симптомов, вызванных гипоксической ишемической энцефалопатией, различается. Одним из распространенных и наиболее эффективных методов лечения является терапевтическое переохлаждение, также известное как охлаждение. Медицинский персонал применяет охлаждающую терапию в течение шести часов после кислородного голодания; лечение длится до трех дней. Персонал наносит средство непосредственно на голову через охлаждающую насадку или по всему телу.
Другие варианты терапии зависят от пораженных или нарушенных функций ребенка.Некоторые из этих методов лечения облегчают боль или стимулируют активность. Ниже приведены специализированные методы лечения пациентов с кислородной недостаточностью:
- Физическая
- Профессиональная
- Речь и язык
- Поведенческая и эмоциональная
- Массаж
- Развлекательная
Детям с церебральным параличом также требуется дополнительное хирургическое и медикаментозное лечение. такие как селективные дорсальные ризотомии, ортопедические операции и нейронтин.
Как предотвратить гипоксическую ишемическую энцефалопатию?Хотя кислородного голодания нельзя полностью избежать, мать и специалисты могут принять определенные меры предосторожности, чтобы снизить вероятность развития гипоксической ишемической энцефалопатии. Мать может избегать употребления алкоголя и поговорить со своим врачом о существующих состояниях и возможности заражения. Квалифицированные врачи должны уделять пристальное внимание мониторингу плода, правильно использовать родовые инструменты и общаться с матерью и другими практикующими врачами в случае возникновения родовых осложнений.
Долгосрочные исходы гипоксически-ишемической энцефалопатии
Долгосрочные исходы у детей, рожденных с гипоксически-ишемической энцефалопатией (ГИЭ), могут варьироваться в широких пределах: от отсутствия длительных эффектов до обширных физических и интеллектуальных нарушений, требующих круглосуточного ухода. . Насколько серьезно ГИЭ влияет на человека, зависит от множества факторов, в том числе:
- Степень кислородного голодания: Если поступление кислорода у ребенка резко или полностью прекращено, их длительное повреждение головного мозга может быть более серьезным.
- Продолжительность кислородного голодания: Младенцы, лишенные кислорода на более длительный срок, с большей вероятностью будут иметь необратимые осложнения со здоровьем.
- Состояние ребенка до инцидента с кислородным голоданием: Например, у недоношенных детей более хрупкий мозг и они более уязвимы для повреждений в результате кислородного голодания.
- Лечение сразу после инцидента с кислородным голоданием: Новейшее лечение, называемое терапевтической гипотермией, может свести к минимуму или предотвратить длительное повреждение головного мозга, если его проводить очень скоро после того, как ребенок лишился кислорода (это лечение настолько важно, что его отсутствие своевременно является формой врачебной халатности).
- Уход на протяжении всего развития ребенка: Существует множество методов лечения и терапии, которые могут принести пользу детям с ГИЭ и сопутствующими заболеваниями.
Чтобы определить прогноз младенца с ГИЭ после рождения, врачи могут использовать стадию Sarnat. При определении стадии Sarnat учитывается клиническая картина, результаты обследования, продолжительность заболевания и наличие судорог у ребенка. I стадия Sarnat считается «легкой», HIE, стадия II — «средней», а стадия III — «тяжелой» (1). Хотя стадирование по шкале Sarnat является полезным диагностическим инструментом, его прогностическая ценность несколько ограничена, и его следует использовать в сочетании с другими неонатальными оценками (2, 3).
Дети с ГИЭ могут иметь физические и / или интеллектуальные нарушения, в зависимости от того, какие области мозга поражены. Способы, которыми это повлияет на отдельного ребенка, могут быть не полностью ясны, пока он не вырастет и не начнет пропускать этапы развития. На этом этапе у некоторых детей с ГИЭ диагностируются связанные состояния, такие как следующие:
Хотя многие из этих состояний неизлечимы, симптомы и качество жизни можно улучшить с помощью различных методов лечения / терапии, вспомогательных и адаптивных технологий. , служебные животные и другие виды поддержки.
О справочном центре HIE и юридических центрах ABC
Справочный центр HIE находится в ведении юридического центра ABC, юридической фирмы, занимающейся врачебной халатностью, которая занимается исключительно случаями, связанными с HIE и другими родовыми травмами. Наши юристы имеют более чем 100-летний совместный опыт работы с этим типом права и защищают интересы детей с ГИЭ и связанными с ними инвалидностями с момента основания фирмы в 1997 году. счета, потеря заработной платы (если одному или обоим родителям приходится пропускать работу, чтобы ухаживать за своим ребенком), вспомогательные технологии и другие предметы первой необходимости.
Если вы подозреваете, что причиной ГИЭ у вашего ребенка была халатность со стороны врача, свяжитесь с нами сегодня, чтобы узнать больше о расследовании дела. Мы предоставляем бесплатные юридические консультации, во время которых мы проинформируем вас о ваших юридических вариантах и ответим на любые ваши вопросы. Более того, вы не будете платить ничего на протяжении всего судебного процесса , если мы не добьемся благоприятного урегулирования (без комиссии, если мы не выиграем!)
Вы также можете обратиться к нам с запросами, которые не связаны с злоупотреблением служебным положением.Мы не можем предоставить индивидуальные медицинские консультации, но мы будем рады найти для вас информационные ресурсы.
Источники
- Сарнат, Х. Б., и Сарнат, М. С. (1976). Энцефалопатия новорожденных после дистресса плода: клиническое и электроэнцефалографическое исследование. Архив неврологии, 33 (10), 696-705.
- Liauw, L., Van Der Grond, J., Van Den Berg-Huysmans, A. A., Laan, L. A. E. M., van Buchem, M. A., & van Wezel-Meijler, G. (2008). Есть ли способ предсказать исход (в ближайшем будущем) новорожденных с гипоксически-ишемической энцефалопатией на основе МРТ?Американский журнал нейрорадиологии, 29 (9), 1789-1794.
- Wu, Y. (нет данных). Клиника, диагностика и лечение энцефалопатии новорожденных. Получено 29 марта 2019 г. с https://www.uptodate.com/contents/clinical-features-diagnosis-and-treatment-of-neonatal-encephalopathy
Связанные ресурсы
Долгосрочные эффекты асфиксии и гипоксии при рождении -Ишемическая энцефалопатия
Асфиксия при рождении возникает, когда мозг ребенка испытывает недостаток кислорода незадолго до, во время или после рождения.Это может быть связано с перебоями в транспортировке насыщенной кислородом крови от матери к ее будущему ребенку, проблемами с кровообращением в организме ребенка или (если это происходит после рождения) закупоркой дыхательных путей.
Асфиксия при рождении часто вызывает гипоксически-ишемическую энцефалопатию (ГИЭ), форму повреждения головного мозга новорожденных, которая может привести к церебральному параличу (ДЦП), эпилепсии и другим нарушениям. Если у ребенка ГИЭ, ему следует назначить терапевтическую гипотермию вскоре после возникновения асфиксии при рождении; это может минимизировать степень необратимого повреждения головного мозга.
Поскольку асфиксию при рождении, ГИЭ и связанную с этим инвалидность часто можно предотвратить, родители могут подать иск о родовой травме. Адвокаты юридической фирмы ABC Law Centers, расположенной в Детройте, могут помочь.
Бесплатный обзор корпуса | Доступно 24/7 | Никаких комиссий, пока мы не выиграем
Телефон (бесплатный): 888-419-2229
Нажмите кнопку Live Chat в своем браузере
Заполните нашу онлайн-форму для связи
Соответствующая терминология
Термины, которые иногда используются как синонимы к асфиксии при рождении, включают асфиксию новорожденных, асфиксию перинатальную, асфиксию в родах, неонатальную энцефалопатию и гипоксически-ишемическую энцефалопатию; однако каждый термин имеет свое уникальное значение.
Что вызывает асфиксию при рождении?
Внутри матки богатая кислородом кровь матери проходит из матки через плаценту и пуповину, чтобы достичь ребенка. Кровеносные сосуды, проходящие между маткой и плацентой, называемые маточно-плацентарной циркуляцией , действуют аналогично легким; В этих сосудах происходит газообмен.
Все, что влияет на кровоток по этому пути, может повлиять на оксигенацию ребенка. Таким образом, если у матери падает артериальное давление или возникают проблемы с маткой (маткой), плацентой или пуповиной, у ребенка может возникнуть асфиксия при родах.В некоторых случаях, таких как полная отслойка плаценты или сдавление пуповины, ребенок может быть полностью лишен богатой кислородом крови, и тогда ему придется полагаться на резервы плода. Такие случаи являются неотложной акушерской помощью, и ребенок должен быть доставлен сразу до того, как асфиксия при рождении вызовет повреждение мозга.
Все, что влияет на нормальный кровоток матери и плода, может повлиять на оксигенацию ребенка и вызвать ГИЭ
Общие причины и факторы риска асфиксии при рождении включают:
Краткосрочные последствия асфиксии при рождении
Асфиксия при рождении возникает при нарушении газообмена между матерью и плодом.Состояние, известное как гипоксия , является ранней стадией асфиксии при рождении. Гипоксия характеризуется недостаточным уровнем кислорода в крови и тканях. Уровень углекислого газа у плода также увеличится, что известно как гиперкарбия . Когда возникает тяжелая гипоксия, плод начинает вырабатывать энергию без кислорода в процессе, известном как анаэробный метаболизм . В результате этого процесса в крови ребенка накапливается молочная кислота (1).Асфиксия при рождении также может вызвать у ребенка ацидоз — процесс, при котором кровь становится кислой (2). Ацидоз и гипоксия могут вызвать снижение функции сердца, что может привести к очень низкому кровяному давлению у ребенка ( гипотония ) и снижению притока крови к мозгу ( ишемия ).
Ишемия может вызвать дальнейшую гипоксию, по существу создавая порочный круг. Гипоксия и ишемия вызывают серию событий, которые нарушают энергетические пути в клетках, что может усугубить уже существующее повреждение клеток головного мозга.Когда мозг находится в гипоксически-ишемическом состоянии, вызванном длительной асфиксией при рождении, мозг лишен не только кислорода, но и глюкозы и других питательных веществ.
В целом, чем дольше мозг находится в гипоксически-ишемическом состоянии, тем серьезнее будет повреждение головного мозга (1).
Степень гипоксически-ишемической травмы головного мозга у ребенка зависит от следующих факторов:
- Степень тяжести асфиксии при рождении
- Сколько длится асфиксия при рождении
- Возраст и резервы ребенка
- Ведение ребенка во время и после родов
Долгосрочные последствия асфиксии при рождении: побочные эффекты гипоксически-ишемической энцефалопатии (ГИЭ)
Если асфиксия при рождении достаточно серьезна, чтобы повредить мозг, у ребенка обычно развивается гипоксически-ишемическая энцефалопатия (ГИЭ) вскоре после рождения.ГИЭ — это черепно-мозговая травма, которая может прогрессировать до необратимого повреждения мозга и долгосрочных состояний, таких как церебральный паралич.
Клинические признаки ГИЭ у младенцев:
- Неонатальные судороги
- Гипотония , при которой ребенок вялый и вялый.
- Плохое питание
- Угнетенный уровень сознания , при котором ребенок не бдителен.
- Проблемы с множественными органами , включая легкие, печень, сердце, кишечник и т. Д.
- Плохие рефлексы ствола головного мозга , такие как проблемы с дыханием, ненормальная реакция на свет, артериальное давление и проблемы с сердцем.
Гипоксико-ишемическая энцефалопатия — наиболее частая причина судорог у новорожденных (3). Приступы необходимо быстро диагностировать и лечить, поскольку они могут способствовать распространению черепно-мозговой травмы. Также очень важно, чтобы медицинская бригада знала о любых других проблемах ребенка, чтобы они могли обеспечить надлежащее лечение. Например, младенцам, страдающим сердечными заболеваниями, часто требуются сердечные препараты.Младенцам с проблемами дыхания могут потребоваться дыхательные трубки и дыхательные аппараты. Неспособность правильно управлять сердцем ребенка, кровяным давлением и дыханием может вызвать дальнейшее повреждение головного мозга и усугубить долгосрочные последствия асфиксии при рождении.
Недоношенные дети могут не проявлять каких-либо признаков, которые проявляются у доношенных детей. Одна из причин этого заключается в том, что нервная система недоношенных и доношенных детей различается. Гипоксически-ишемическое повреждение головного мозга у недоношенного ребенка может протекать бесследно, при этом у ребенка мало или совсем нет явных признаков.
У доношенных детей ГИЭ обычно включает повреждение базальных ганглиев и водоразделов головного мозга. Однако могут быть и другие виды травм. Например, у недоношенных детей часто наблюдается перивентрикулярная лейкомаляция (ПВЛ) (4).
Лечение: терапевтическая гипотермия может остановить ГИЭ и минимизировать долгосрочные последствия асфиксии при рождении
Ребенок, получающий охлаждение головы (терапию гипотермией) по поводу гипоксически-ишемической энцефалопатии
В настоящее время стандартом ухода за младенцами с диагнозом ГИЭ является получение терапевтической гипотермии (охлаждение мозга).Большинство руководств гласят, что врачи должны назначить терапию гипотермией в течение шести часов с момента возникновения асфиксии при рождении. Как правило, это означает, что ребенка с ГИЭ необходимо охладить в течение шести часов после рождения.
Исследования показывают, что терапевтическая гипотермия замедляет почти каждый повреждающий процесс, который начинается, когда мозг ребенка испытывает асфиксию при рождении. Во время процедуры температура тела ребенка охлаждается на несколько градусов ниже нормы в течение 72 часов. Было показано, что такое охлаждение мозга предотвращает церебральный паралич или снижает тяжесть заболевания.Правильное лечение гипотермии ребенку с ГИЭ имеет решающее значение для предотвращения или улучшения долгосрочных последствий асфиксии при рождении.
Для получения дополнительной информации о лечебной гипотермии посетите наши страницы ниже:
Отдаленные последствия асфиксии при рождении
У многих младенцев, страдающих асфиксией при рождении, вскоре после рождения диагностируется гипоксически-ишемическая энцефалопатия. Не все дети с ГИЭ получают необратимое повреждение головного мозга. Некоторые дети не будут испытывать долгосрочных последствий асфиксии при рождении или каких-либо скрытых проблем от ГИЭ.Однако у младенцев с повреждением головного мозга, вызванным асфиксией при рождении или ГИЭ, могут развиться следующие состояния:
Долгосрочные последствия асфиксии при рождении зависят от травмированной части мозга и тяжести травмы. У недоношенных и доношенных детей есть две общие модели травм (5):
- Когда младенец испытывает « острая глубокая» или «острая почти полная» асфиксия , обычно имеет место повреждение глубокого серого вещества головного мозга (5).Это может включать базальные ганглии, таламус и ствол мозга (6).
- Когда младенец переживает частичную длительную асфиксию , более вероятно парасагиттальное повреждение коры головного мозга и подкоркового белого вещества. Это можно назвать «водоразделом» травмы (5).
Младенцы могут также испытывать частичную длительную асфиксию наряду с острой глубокой асфиксией, которая вызывает «смешанную картину травм головного мозга» ГИЭ.
Когда у ребенка гипоксически-ишемическая энцефалопатия, поражения головного мозга часто обнаруживаются при сканировании головного мозга.В зависимости от характера асфиксии при рождении и состояния ребенка поражения могут быть в любой части мозга, упомянутой выше (и других).
Прогнозирование долгосрочных последствий асфиксии при рождении на основе локализации повреждения головного мозга
Степень и локализация повреждения головного мозга могут помочь врачам предсказать долгосрочные последствия асфиксии при рождении, а также типы хронических проблем, которые могут быть у ребенка. Ниже перечислены области мозга, которые могут быть повреждены, а также краткое описание функций организма, которые эти области помогают контролировать.Три основные части мозга — это головной мозг, мозжечок и ствол мозга, все они содержат как серое, так и белое вещество.
Головной мозг
Самая большая часть мозга, головной мозг, содержит нервные центры, которые контролируют движение, рассуждение, память, восприятие и суждения (7). Поверхность головного мозга называется корой головного мозга, которая помогает координировать моторную и сенсорную информацию (8). Головной мозг состоит из четырех долей, каждая из которых играет важную роль в работе мозга.
Лобные доли головного мозга
Лобные доли играют важную роль в таких высокоуровневых функциях, как движение, внимание, планирование и суждение. Эти доли также управляют эмоциями и импульсами и сильно влияют на личность человека.
Теменные доли головного мозга
Теменные доли находятся за лобными долями. Они работают, чтобы организовать и интерпретировать сенсорную информацию, которая отправляется из других областей мозга.
Височная доля головного мозга
Эти мочки расположены возле ушей. Они играют важную роль в таких функциях, как понимание языка, зрительная память (то есть распознавание лиц) и понимание эмоций (7).
Затылочная доля головного мозга
Затылочная доля находится в задней части головы и содержит первичную зрительную кору, которая контролирует зрение. Затылочная доля очень важна как для получения, так и для обработки зрительной информации.Например, он участвует в чтении и понимании прочитанного (9).
Мозжечок
Мозжечок находится сразу за верхней частью ствола головного мозга, где головной мозг соединяется со спинным мозгом. Хотя мозжечок составляет примерно 10 процентов от общей массы мозга, он содержит примерно половину нейронов мозга.
Мозжечок играет важную роль в двигательном контроле (произвольном движении). Когда мозжечок функционирует нормально, движения мышц будут плавными, а у человека будет хорошая осанка, равновесие, координация и речь.Хотя повреждение мозжечка не приведет к параличу, оно может вызвать проблемы с балансом, неэффективное движение, тремор и другие проблемы с двигательным контролем. Этот тип повреждения головного мозга также затрудняет освоение детьми новых двигательных задач (10).
Ствол головного мозга
Ствол мозга расположен перед мозжечком и передает сигналы от головного мозга к спинному мозгу. Он помогает регулировать такие функции организма, как дыхание, частоту сердечных сокращений и артериальное давление, и имеет решающее значение для выживания (11).Ствол мозга состоит из трех основных частей: моста, среднего мозга и продолговатого мозга.
Понс
Мост — самая большая часть ствола головного мозга. Он участвует в передаче сенсорной информации. Он также контролирует движения лица.
Средний мозг
Средний мозг помогает обрабатывать как зрительную, так и слуховую информацию. Он также играет роль в управлении движением глаз.
продолговатый мозг
Продолговатый мозг — это то, что соединяет ствол мозга с остальной частью мозга.Он контролирует сердце и легкие, а также регулирует важные функции, такие как дыхание и глотание (7).
Адвокаты Детройта, Мичиган, помогают детям с асфиксией при рождении
Случаи асфиксии при рождении и гипоксически-ишемической энцефалопатии требуют обширных знаний как в области права, так и в медицине. Юридические центры ABC были созданы исключительно для рассмотрения дел о родовых травмах, и наши адвокаты обладают необходимыми знаниями для победы. Наша фирма находится недалеко от Детройта, штат Мичиган, но мы занимаемся делами во многих частях страны.
Свяжитесь с юридическими центрами ABC сегодня, чтобы узнать больше. Мы будем рады поговорить с вами, даже если вы еще не уверены, произошла ли злоупотребление служебным положением или вы хотите продолжить рассмотрение дела. Наша команда может ответить на ваши вопросы и проинформировать вас о ваших юридических вариантах. Вы ничего не заплатите на протяжении всего судебного процесса, если мы не выиграем ваше дело.
Бесплатный обзор корпуса | Доступно 24/7 | Никаких комиссий, пока мы не выиграем
Телефон (бесплатный): 888-419-2229
Нажмите кнопку Live Chat в своем браузере
Заполните нашу онлайн-форму для связи
Подробнее о нашей фирме
Подробнее о расследовании дела о родовой травме
Видео: отдаленные последствия асфиксии при рождении
Посмотрите видео, в котором поверенные по родовым травмам Джесси Рейтер и Ребекка Уолш обсуждают долгосрочные последствия асфиксии при рождении.Асфиксию при рождении часто можно предотвратить, если ребенок быстро родится при первых признаках дистресса. Неспособность быстро родить ребенка может вызвать длительную кислородную недостаточность, гипоксически-ишемическую энцефалопатию (ГИЭ), необратимое повреждение головного мозга и такие состояния, как церебральный паралич.
Видео: как выражается асфиксия при рождении?
Источники:
- (нет данных). Получено 31 января 2019 г. с https://www.uptodate.com/contents/systemic-effects-of-perinatal-asphyxia .
- Эйрес-де-Кампос, D.(2017). Острая гипоксия / ацидоз плода. В неотложной акушерской помощи (стр. 7-25). Спрингер, Чам.
- Кан, С. К., & Кадам, С. Д. (2015). Неонатальные судороги: влияние на исходы нервного развития. Границы педиатрии, 3, 101.
- Гопагонданахалли, К. Р., Ли, Дж., Фэи, М. К., Хант, Р. В., Дженкин, Г., Миллер, С. Л., и Малхотра, А. (2016). Недоношенная гипоксически-ишемическая энцефалопатия. Границы педиатрии, 4, 114.
- (нет данных). Получено 31 января 2019 г. с сайта https: // www.uptodate.com/contents/clinical-features-diagnosis-and-treatment-of-neonatal-encephalopathy
- Пастернак, Дж. Ф., и Гори, М. Т. (1998). Синдром острой почти тотальной внутриутробной асфиксии у доношенных детей. Детская неврология, 18 (5), 391-398.
- Мозг: функции и анатомия частей, схемы, состояния, советы по здоровью. (нет данных). Получено 31 января 2019 г. с сайта https://www.healthline.com/human-body-maps/brain#brain-diagram .
- Кора головного мозга. (нет данных). Получено 31 января 2019 г. с сайта https: // www.merriam-webster.com/dictionary/cerebral cortex
- Анатомия и изображения затылочной доли | Карты тела. (нет данных). Получено 31 января 2019 г. с сайта https://www.healthline.com/human-body-maps/occipital-lobe#1 .
- Функция, анатомия и определение мозжечка | Карты тела. (нет данных). Получено 31 января 2019 г. с сайта https://www.healthline.com/human-body-maps/cerebellum#2 .
- Николлс, Дж. Г. и Патон, Дж. Ф. (2009). Ствол мозга: нейронные сети, жизненно важные.

