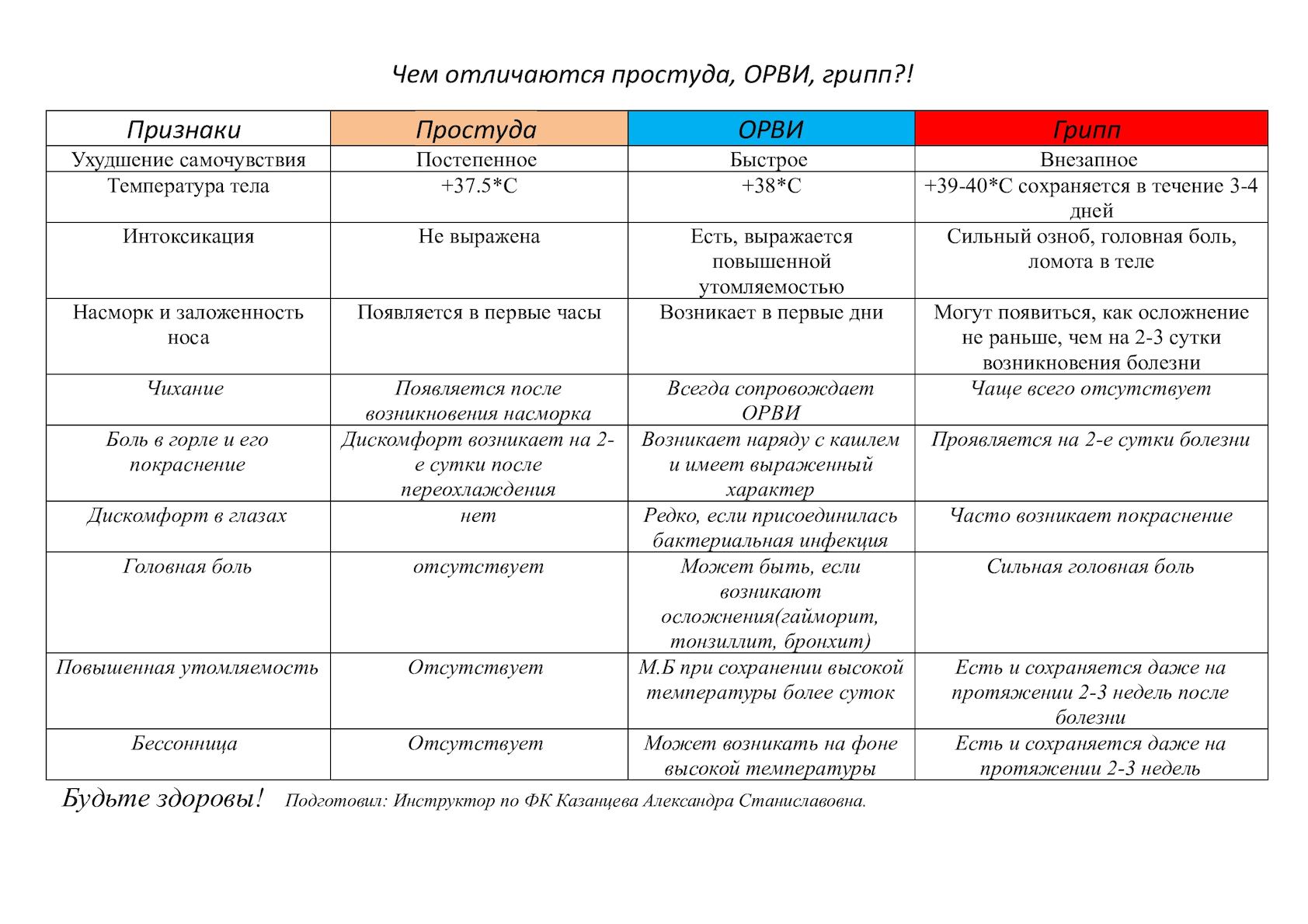
симптомы, эффективное лечение и профилактика
Жалобы на насморк, кашель, боль в горле – одни из самых популярных на приеме у детского врача. Казалось бы, это всего лишь обычная простуда, однако стоит задуматься о том, сколько неприятных минут, бессонных ночей, тревог, потраченного времени и денег на осмотры врачей и лекарственные препараты с ней связано. Ребенок не может посещать учебные заведения, отстает от образовательной программы, не принимает участия в соревнованиях и выступлениях. Родители не высыпаются, получают дополнительную нагрузку и либо не могут идти на работу из-за необходимости ухода за заболевшим, либо уходят в тревоге, и, в конце концов, тоже заболевают, заразившись от ребенка.
Вопросы о том, что можно сделать, чтобы не допускать заражений респираторными вирусными инфекциями, как ускорить выздоровление, какие именно препараты наиболее эффективны в лечении ОРВИ у детей, постоянно звучат в кабинете педиатра, на родительских форумах и в чатах.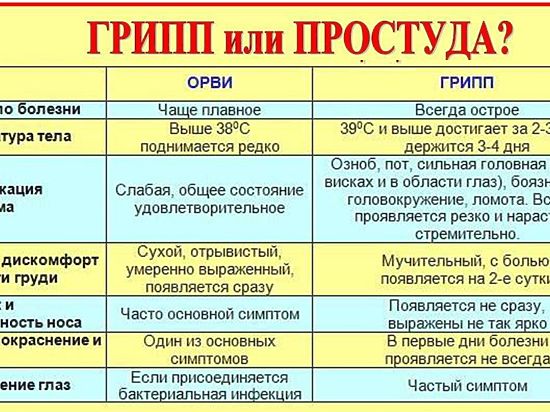
Причины
Первое, что приходит в голову родителям, когда они замечают симптомы ОРВИ у ребенка — переохлаждение. В памяти начинают всплывать ситуации, когда ребенок бегал босиком по холодному полу, вышел раздетым из ванной комнаты, не надел шапку или шарф на улице, сидел у приоткрытого окна или пил слишком холодный напиток. Хотя инфекционная природа заболевания давно уже изучена и известна, многие люди до сих пор уверены, что основная причина этих болезней – переохлаждение. Действительно, это утверждение имеет право на жизнь, особенно когда есть сочетание заражения и переохлаждения или мы имеем дело с «дремлющей» в организме инфекцией. В этом случае 
Однако нельзя все причины ОРВИ свести только к инфекции и переохлаждению. Существуют и другие важные факторы. Один из них —
Другим негативным фактором является стресс, который приходится переживать детям, адаптирующимся к новому коллективу или педагогу, после переезда на новое место проживания или если взаимоотношения в коллективе складываются не очень гладко. У детей подобная адаптация может занимать около полугода.
Врачи часто обращают внимание на соблюдение режима дня. Полноценный ночной, а для дошкольников и дневной отдых, сон без пробуждений, хождений, кошмаров, с достаточно быстрым засыпанием и легким пробуждением – залог здоровья. Важно не допускать позднего отхода ко сну.
Полноценный ночной, а для дошкольников и дневной отдых, сон без пробуждений, хождений, кошмаров, с достаточно быстрым засыпанием и легким пробуждением – залог здоровья. Важно не допускать позднего отхода ко сну.
Следующей причиной заражения ОРВИ является недостаточная гигиена у детей. Дети часто меняются игрушками, засовывают их в рот, трогают лицо и глаза немытыми руками, не моют руки после возвращения с прогулки или посещения туалета, перед едой. Кроме того, дети любят делиться едой, откусывать от одного пирога или яблока и таким образом заражаются.
Это то, что касается внешних причин заболевания. Существуют другие, внутренние факторы, из-за которых ОРВИ могут буквально «прилипать» к ребенку. К таким ситуациям можно отнести наличие аллергических заболеваний, протекающих с вовлечением слизистых оболочек. В результате этого слизистые уже не могут эффективно защищаться от вторжения чужеродных агентов. Восприимчивость к ОРВИ возрастает. Другие обстоятельства возникают при наличии у ребенка гипертрофии аденоидов. Здесь получается своеобразный замкнутый круг, когда гипертрофия поддерживается частыми респираторными заболеваниями и наоборот, в разросшейся ткани аденоидов вольготно размножаются, а иногда и надолго задерживаются различные патологические агенты.
Другие обстоятельства возникают при наличии у ребенка гипертрофии аденоидов. Здесь получается своеобразный замкнутый круг, когда гипертрофия поддерживается частыми респираторными заболеваниями и наоборот, в разросшейся ткани аденоидов вольготно размножаются, а иногда и надолго задерживаются различные патологические агенты.
Нарушения функции щитовидной железы иногда находят отражение в повышенной восприимчивости к инфекциям.
В настоящее время особенно популярным стало определять уровень различных витаминов и микроэлементов и корректировать отклонения. Опыт таких исследований показывает, что наиболее часто встречаются изменения в уровне витамина Д3 и показателях, характеризующих насыщение железом. Недостаточность витамина Д3 и снижение уровня железа
И лишь в последнюю очередь стоит подумать о нарушениях в иммунном ответе из-за которых ребенок болеет столь часто. Однако такие дети болеют подолгу, тяжело, с осложнениями. Практически каждый случай заболевания требует назначения антибактериальных препаратов, а зачастую и стационарного лечения. Такие ситуации вряд ли могут остаться незамеченными педиатром, наблюдающим ребенка. Для коррекции состояния приходится подключать специалистов-иммунологов.
Однако такие дети болеют подолгу, тяжело, с осложнениями. Практически каждый случай заболевания требует назначения антибактериальных препаратов, а зачастую и стационарного лечения. Такие ситуации вряд ли могут остаться незамеченными педиатром, наблюдающим ребенка. Для коррекции состояния приходится подключать специалистов-иммунологов.
Симптомы
Проявления заболевания у детей достаточно сильно отличаются по степени тяжести. Они могут варьировать от легких, когда проявления ограничиваются чиханием, насморком, небольшим кашлем, слабостью, снижением аппетита, а температура тела остается нормальной, до среднетяжелых и даже тяжелых. В случае среднетяжелого течения инфекции, помимо вышеописанных симптомов, может регистрироваться повышенная температура тела, более выраженные катаральные явления (насморк, кашель), резкое снижение аппетита, сильная слабость, головная боль, боли в мышцах, суставах. Тяжелое состояние требует серьезной врачебной помощи и проявляется в виде полного отказа от еды, питья, резкой слабости, выраженной вялости, вместе с уже упомянутыми проявлениями.
Некоторые инфекции имеют яркие, узнаваемые черты. Так, аденовирусная инфекция часто проявляется конъюнктивитом, увеличением лимфоузлов, обильным слизистым отделяемым из носа. Осиплость голоса или даже развитие крупа (состояния, при котором происходит сужение дыхательных путей из-за отека слизистой) – черты парагриппа. Грипп протекает с выраженной головной, мышечной, суставной болью, высокой лихорадкой и поначалу неярко выраженным насморком и кашлем.
Диагностика
Если ребенок заболел, важно понять, каким возбудителем вызвана болезнь, чтобы правильно назначить лечение, а также сделать прогноз возможных осложнений. Дело в том, что, например, респираторно-синцитиальная вирусная (РСВ) инфекция у детей до года может протекать с серьезными нарушениями дыхания, что требует от врачей должной настороженности.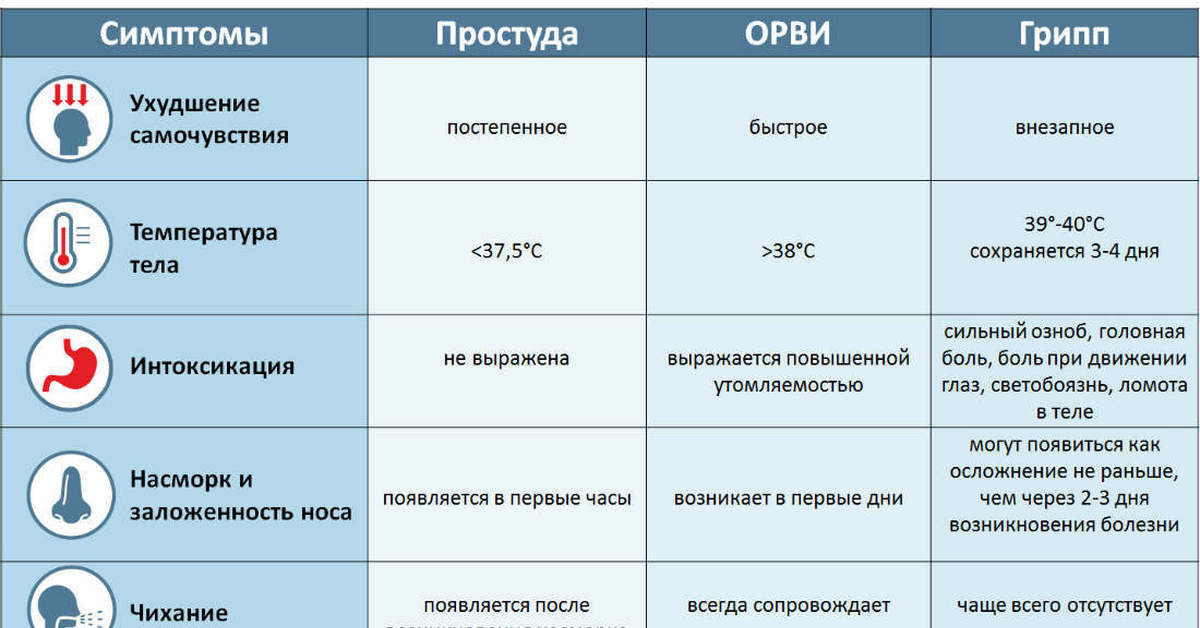 А для гриппа существует эффективная противовирусная терапия, которую необходимо назначать как можно раньше от начала болезни. Поэтому мы стараемся провести необходимую диагностику при первом обращении. Для этого используют экспресс-тесты для определения вируса гриппа и РСВ инфекции. Кроме того, есть возможность диагностики с помощью ПЦР и многих других возбудителей ОРВИ. Также есть возможность быстрой диагностики стрептококковой инфекции, которая может «маскироваться» под ОРВИ, протекая с лихорадкой, болью в горле, а иногда и заложенностью носа.
А для гриппа существует эффективная противовирусная терапия, которую необходимо назначать как можно раньше от начала болезни. Поэтому мы стараемся провести необходимую диагностику при первом обращении. Для этого используют экспресс-тесты для определения вируса гриппа и РСВ инфекции. Кроме того, есть возможность диагностики с помощью ПЦР и многих других возбудителей ОРВИ. Также есть возможность быстрой диагностики стрептококковой инфекции, которая может «маскироваться» под ОРВИ, протекая с лихорадкой, болью в горле, а иногда и заложенностью носа.
Почему это важно?
-
Если ребенок болен ОРВИ, специфическая терапия не требуется, доктор даст рекомендации по облегчению симптомов болезни.
-
Если ребенок болен гриппом, важно установить диагноз и начать специфическую терапию как можно скорее.
-
Если это стрептококковая инфекция, ребенку показана антибактериальная терапия. Эта инфекция может приводить к тяжелым осложнениям со стороны сердца, почек, суставов.

-
РС-вирус- основная причина инфекций нижних дыхательных путей, самая частая причина бронхиолита и пневмонии у детей до 1 года, одна из самых частых причин дыхательных нарушений, приводящих к госпитализации.
Экспресс-тест – это не больно, не страшно, а главное, результат мы получаем в течение 5-10 минут. Вам не требуется ехать в лабораторию, сдавать кровь из вены или мазок и ждать результатов в течение нескольких дней. Наши врачи выполняют экспресс-тесты как на приеме в клинике, так и на дому.
Кроме исследований, направленных на диагностику возбудителя, проводят анализы крови для принятия решения о необходимости начала антибактериальной терапии в случае развития осложнений подобного плана: клинический анализ крови с лейкоцитарной формулой, определение уровня с-реактивного белка, скорости оседания эритроцитов. При необходимости обследование может быть дополнено рентгенограммой органов грудной клетки и придаточных пазух носа.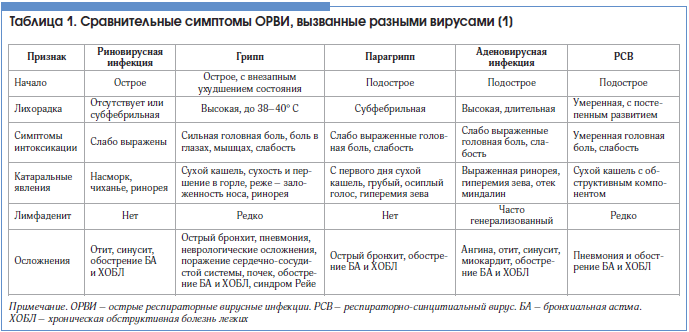
Лечение
Лечение ОРВИ осуществляется под контролем врача и является преимущественно симптоматическим. Рекомендуется домашний режим, причем совершенно не обязательно заставлять ребенка находится в постели. Активность ребенка должна соответствовать его самочувствию. При хорошем общем состоянии не противопоказаны недолгие гигиенические водные процедуры. А при легком течении болезни можно даже выйти на прогулку. Конечно, контакты с другими детьми разумнее исключить, чтобы предотвратить дальнейшее распространение заболевания. Особых диетических рекомендаций не требуется. Интересно, что в разных странах по-разному подходят к лечению ОРВИ с точки зрения температуры пищи. Так, в некоторых странах при болях в горле совершенно официально рекомендуют как теплые, горячие, так и наоборот, холодные напитки.
При лечении простуды особенно важно соблюдать питьевой режим. Влага организма ребенка расходуется на продукцию слизи при насморке и кашле, теряется при одышке и повышении температуры. Для того, чтобы слизь отходила легче, температура снижалась быстрее, да и общая интоксикация уменьшалась, необходимо достаточное питье. Для этого подойдет как обычная вода, так и другие любимые напитки ребенка. Отделение слизи из носа может облегчить орошение слизистой солевыми растворами. При выраженной заложенности носа подключают сосудосуживающие средства, которые можно использовать очень аккуратно, строго по инструкции из-за высокого риска передозировки и других побочных эффектов. Средства против кашля, что были столь популярны раньше, в настоящее время все больше уходят из каждодневных назначений. Их роль представляется весьма спорной. Поэтому мы стараемся избегать их использования. Вместо них предпочитаем простые, «народные» способы: теплое питье (вода, чай, компот, бульон), рассасывание меда (разрешено для детей старше 1 года, у которых нет риска аллергических реакций), рассасывание различных леденцов (осторожно, из-за риска вдыхания леденца при приступе кашля, с 6 летнего возраста).
Для того, чтобы слизь отходила легче, температура снижалась быстрее, да и общая интоксикация уменьшалась, необходимо достаточное питье. Для этого подойдет как обычная вода, так и другие любимые напитки ребенка. Отделение слизи из носа может облегчить орошение слизистой солевыми растворами. При выраженной заложенности носа подключают сосудосуживающие средства, которые можно использовать очень аккуратно, строго по инструкции из-за высокого риска передозировки и других побочных эффектов. Средства против кашля, что были столь популярны раньше, в настоящее время все больше уходят из каждодневных назначений. Их роль представляется весьма спорной. Поэтому мы стараемся избегать их использования. Вместо них предпочитаем простые, «народные» способы: теплое питье (вода, чай, компот, бульон), рассасывание меда (разрешено для детей старше 1 года, у которых нет риска аллергических реакций), рассасывание различных леденцов (осторожно, из-за риска вдыхания леденца при приступе кашля, с 6 летнего возраста). При болях в горле используют различные спреи и препараты для рассасывания. Следует обращать внимание на ограничение по возрасту для их использования. Этиотропная терапия, то есть терапия, направленная на устранение возбудителя ОРВИ, доказана для ежедневной практики на международном уровне лишь для терапии гриппа.
При болях в горле используют различные спреи и препараты для рассасывания. Следует обращать внимание на ограничение по возрасту для их использования. Этиотропная терапия, то есть терапия, направленная на устранение возбудителя ОРВИ, доказана для ежедневной практики на международном уровне лишь для терапии гриппа.
Профилактика
Как же все-таки избежать ОРВИ или, по крайней мере, уменьшить частоту заболеваний? Для того, чтобы переохлаждение не влияло на здоровье ребенка, может помочь разумное закаливание. Кроме того, необходимо обеспечить ребенку достаточное потребление жидкости. Важно не допускать жары в доме, температуру поддерживать на уровне 19-21 градусов Цельсия, своевременно проветривать и поддерживать оптимальный уровень влажности (около 50%).
Соблюдайте строгий режим дня, не допускайте позднего отхода ко сну. Обучите Вашего ребенка мыть руки по возвращению домой, до еды и после посещения туалета, а также менять одежду на домашнюю по возвращении домой. Расскажите, почему важно не трогать лицо, не засовывать пальцы в рот, нос и глаза и почему не стоит откусывать от пирога, который уже надкусил приятель.
Расскажите, почему важно не трогать лицо, не засовывать пальцы в рот, нос и глаза и почему не стоит откусывать от пирога, который уже надкусил приятель.
Стоит проверить, нет ли у ребенка увеличения аденоидов. Это можно сделать на приеме у ЛОР-врача, который может провести эндоскопическое исследование, во время которого можно своими глазами на мониторе увидеть аденоиды. Если в силу возраста или отношения ребенка к эндоскопической процедуре она невозможна, на помощь придет рентгенография носоглотки.
Уточните, не является ли предрасполагающим к частым ОРВИ аллергический процесс. На этот вопрос поможет ответить педиатр, который проведет соответствующую первичную диагностику. В случае выявления аллергии решить проблему поможет врач аллерголог-иммунолог.
Совместно с педиатром проведите лабораторную диагностику уровня витамина Д, показателей железа, функции щитовидной железы.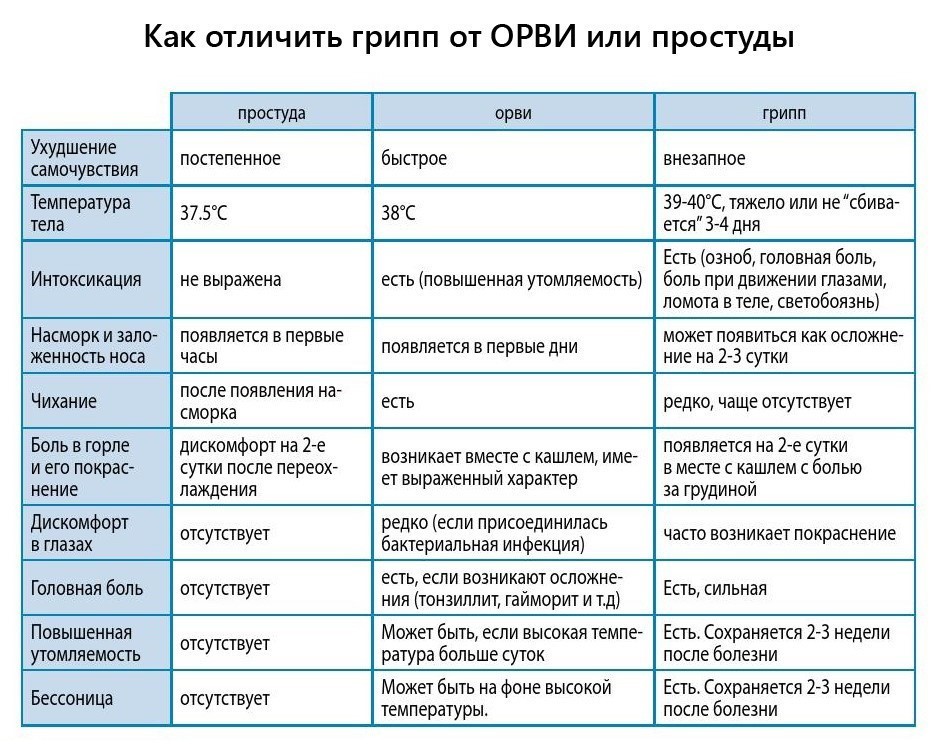 При необходимости педиатр скорректирует рацион питания и назначит необходимые препараты.
При необходимости педиатр скорректирует рацион питания и назначит необходимые препараты.
Хочется предостеречь от излишнего увлечения лекарственными средствами и препаратами на основе трав. Несмотря на популярность у покупателей, не доказана эффективность эхинацеи и чеснока в профилактике простуд у детей. В настоящее время все еще недостаточно данных, подтверждающих эффективность гомеопатических препаратов и пробиотиков в профилактике ОРВИ в детском возрасте.
Большие надежды в лечении и профилактике возлагали на применение высоких доз витаминов Д и С. В настоящее время известно, что дополнительный прием этих витаминов не оказывает влияния на частоту заболеваемости респираторными инфекциями и выраженность их симптомов. Однако витамин С немного (всего на 14%) может сократить их длительность.
Ученым удалось подтвердить, что при дополнительном приеме препарата, содержащего микроэлемент цинк, в течение более 5 месяцев подряд сокращается длительность и выраженность симптомов респираторных инфекций..gif) Кроме того, минерал позволяет уменьшить число эпизодов простудных заболеваний. Однако существенными минусами в его использовании, наряду с длиной курса, являются неприятный вкус и тошнота, которую часто отмечают при его приеме.
Кроме того, минерал позволяет уменьшить число эпизодов простудных заболеваний. Однако существенными минусами в его использовании, наряду с длиной курса, являются неприятный вкус и тошнота, которую часто отмечают при его приеме.
Вакцинация против респираторных инфекций имеет огромное значение. Ежегодно в осенние месяцы проводят иммунизацию против сезонного гриппа. Традиционно в нашей стране у детей используют трехвалентную вакцину. Однако в следующем сезоне можно надеяться на появление новой четырехвалентной вакцины против гриппа, подходящей для использования в детском возрасте. Существуют мнения о том, что вакцина недостаточно эффективна и поэтому делать эту вакцинацию не нужно. С этим утверждением нельзя согласиться. Эффективность вакцины может варьировать у разных людей, это правда. Однако, если заболевает один человек, у которого вакцина не оказалась столь эффективна, а все окружающие его люди привиты, у них эффективность вакцинации может быть достаточно высокой, чтобы не заболеть.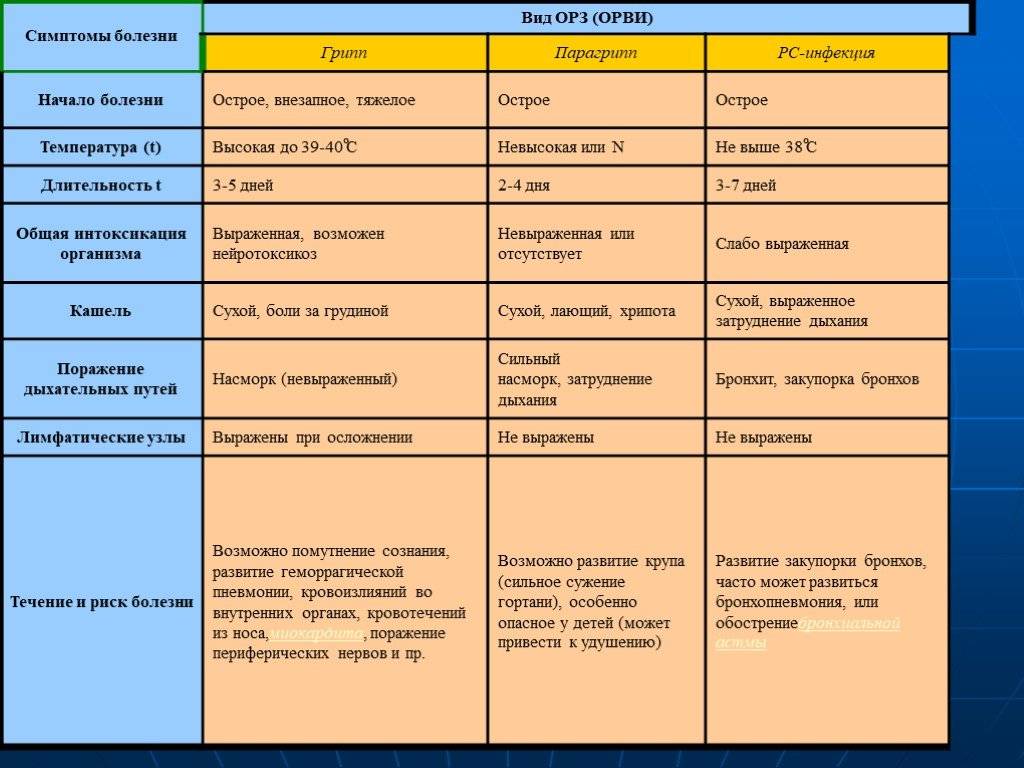 Таким образом, инфекция не будет распространяться дальше, как было бы в случае, если бы окружающие не имели вакцинации. То есть чем шире охват вакцинации, тем ниже риск широкого распространения заболевания. Это особенно важно для защиты ослабленных людей или тех, кому вакцинация противопоказана. Важно помнить, что впервые получающие вакцинацию против гриппа дети до 9-летнего возраста должны быть вакцинированы дважды с интервалом 4 недели. Для особых групп детей раннего возраста давно и эффективно используют препарат на основе моноклональных антител для профилактики РСВ-инфекции, который вводят внутримышечно.
Таким образом, инфекция не будет распространяться дальше, как было бы в случае, если бы окружающие не имели вакцинации. То есть чем шире охват вакцинации, тем ниже риск широкого распространения заболевания. Это особенно важно для защиты ослабленных людей или тех, кому вакцинация противопоказана. Важно помнить, что впервые получающие вакцинацию против гриппа дети до 9-летнего возраста должны быть вакцинированы дважды с интервалом 4 недели. Для особых групп детей раннего возраста давно и эффективно используют препарат на основе моноклональных антител для профилактики РСВ-инфекции, который вводят внутримышечно.
Грипп у детей: начальные симптомы, профилактика
Симптомы гриппа у детей зависят от того, в какой клинической форме протекает заболевание. Для типичной клинической картины гриппа характерно сочетание двух ведущих синдромов — общей интоксикации и катаральных явлений верхних дыхательных путей.
Чаще всего грипп развивается резко: озноб, слабость, боли в теле, слабость, вялость, разбитость, головная боль; еще несколько часов – и температура тела поднимается до 38-40 градусов по Цельсию.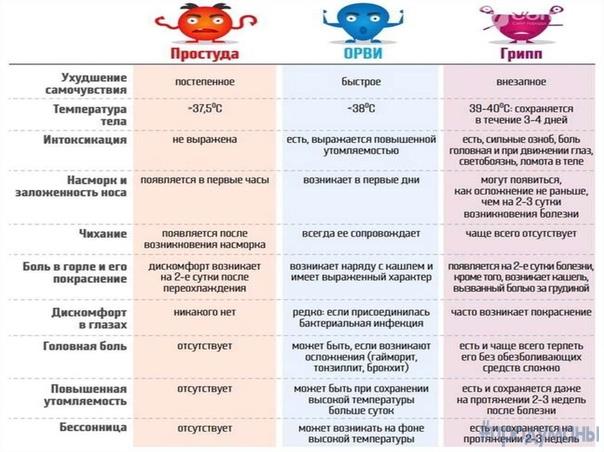 На следующий день (или через день) возникают кашель, насморк. Они, как правило, досаждают ребенку меньше, чем нарушение общего состояния.
На следующий день (или через день) возникают кашель, насморк. Они, как правило, досаждают ребенку меньше, чем нарушение общего состояния.
У грудных детей симптомами гриппа могут быть беспокойство, отказ от груди, срыгивание. Дети подолгу не могут уснуть или, наоборот, весь день спят, нарушая обычный режим и пропуская кормления.
Аппетит у детей при гриппе, как правило, ниже обычного. Сильно тревожиться по этому поводу не стоит, гораздо важнее, пьет ребенок жидкость или нет.
Советы для родителей по вопросам лечения
- Вызвать врача на дом и если диагноз гриппа подтвердится выполнять назначенное лечение.
- Соблюдать постельный режим всем детям независимо от степени тяжести болезни до нормализации температуры тела и стойкого улучшения состояния, но не менее 3-5 дней.
- Не давать антибиотики и сульфаниламиды – на вирус они не действуют и при неосложненном течении гриппа не нужны.
- Не давать в качестве жаропонижающего средства аспирин (ацетилсалициловую кислоту) из-за высокого риска развития синдрома Рея – заболевания, характеризующегося отеком головного мозга, рвотой и спутанностью сознания.

- Не давать детям в возрасте до 12 лет анальгин в связи с высоким риском возникновения таких побочных явлений, как заболевания крови и нарушение функции почек.
- Использовать в качестве жаропонижающего средства парацетамол, который выпускается в разных формах – для маленьких детей в виде сиропа, свечей. Перед тем как дать очередную дозу препарата, которую рассчитает лечащий врач, необходимо измерить ребенку температуру. Если она после предыдущего приема лекарства не повышена, то давать очередную порцию нет необходимости. Не стоит использовать парацетамол более 3-х суток подряд. При неэффективности препарата осуществляется его замена на другой.
- Не капать в нос растворы антибиотиков. Не рекомендуется использование при вирусном насморке сосудосуживающих капель. Если слизь в носу высыхает и ребенок начинает дышать носом, то увлажнять носовые ходы можно каплями физиологического раствора (он есть во всех аптеках). Насморк – это защита, если ему не мешать, он скорее всего пройдет сам (исключение составляет случай, когда присоединяется осложнение).

- Недопустимо без согласования с врачом использовать противокашлевые средства. В домашних условиях главное – предотвратить высыхание мокроты. В этом случае помогут опять же прохладный воздух и обильное питье.
по правилам гигиены:
- Проветривать помещение, в котором находится ребенок, несколько раз в день (на время проветривания переводить ребенка в другое помещение).
- Проводить влажную уборку детской комнаты не менее двух раз в течение дня.
по вопросам профилактики
- На сегодняшний день, самым эффективным методом предупреждения распространения заболевания считается вакцинация. Однако она должна быть проведена своевременно – оптимальные сроки иммунизации сентябрь-октябрь. В период разгара эпидемии метод специфической иммунопрофилактики малоэффективен.
- Иметь в домашней аптечке противовирусные препараты интеферон (в ампулах — капли в нос), виферон (свечи), альгирем (сироп), ремантадин (для детей школьного возраста – в таблетках).
 Дозы и курс лечения согласовать с врачом.
Дозы и курс лечения согласовать с врачом. - Одним из наиболее распространенных и доступных средств для профилактики гриппа является ватно-марлевая повязка (маска). Однако, это недостаточно эффективный метод защиты себя, а при заболевании — окружающих от заражения
- Для профилактики гриппа важно уменьшить число контактов с источниками инфекции, это особенно важно для детей. Не рекомендуется активно пользоваться городским общественным транспортом и ходить в гости и т.п. Дети должны как можно больше гулять: на свежем воздухе заразиться гриппом практически невозможно.
- Необходимо часто мыть руки, так как инфекция легко передается через грязные руки.
по питанию
- Предлагать блюда молочно-растительной диеты в первые 2-3 дня заболевания, затем – по возрасту.
- Давать обильное питье частыми дробными порциями для уменьшения риска обезвоживания – клюквенный или брусничный морс, подслащенную воду с лимоном, настойку шиповника, щелочную минеральную воду без газа.
 Суточный объем жидкости для детей раннего возраста должен составлять на период лихорадки 150 мл на 1 кг веса, после снижения температуры – 100 мл.
Суточный объем жидкости для детей раннего возраста должен составлять на период лихорадки 150 мл на 1 кг веса, после снижения температуры – 100 мл. - Дополнительно необходимо принимать аскорбиновую кислоту и поливитамины. Аскорбиновая кислота (витамин С) способствует повышению сопротивляемости организм. Витамин С применяют внутрь в возрастной дозировки. Следует отметить, что наибольшее количество витамина С содержится в соке квашеной капусты, а также цитрусовых — лимонах, киви, мандаринах, апельсинах, грейпфрутах. Полезен салат из свежей капусты с подсолнечным маслом, содержащий большой запас витаминов и микроэлементов.
- Ежедневно использовать в рационе свежие овощи и фрукты, что позволит повысить общий иммунитет к вирусным заболеваниям, а также значительно облегчит бюджет семьи, по сравнению с затратами на медикаментозные средства.
- Приучить детей к потреблению чеснока. Для того, чтобы дети не отворачивались от его жгучего, горького вкуса, следует его мелко порезать или потолочь и положить на бутерброд с маслом.
 Можно истолченный чеснок настоять на молоке — 2 — 3 дольки на полстакана молока. И даже детям до года можно в таком виде давать по каплям. «Чесночное» масло: измельченный чеснок смешать со сливочным маслом и использовать для бутербродов. Очищенный чеснок можно повесить в марлевом мешочке над кроватью или положить под подушку.
Можно истолченный чеснок настоять на молоке — 2 — 3 дольки на полстакана молока. И даже детям до года можно в таком виде давать по каплям. «Чесночное» масло: измельченный чеснок смешать со сливочным маслом и использовать для бутербродов. Очищенный чеснок можно повесить в марлевом мешочке над кроватью или положить под подушку.
ОРВИ у детей✔️: симптомы и лечение, отличие от гриппа и коронавируса
Симптомы ОРВИ у детей можно спутать с сезонным гриппом и тяжёлой инфекцией COVID-19. Зная, в чём их принципиальные отличия, вы вовремя дадите ребёнку правильное лечение.
Содержание:
Почему дети часто болеют ОРВИ и что это такое?
ОРВИ — одно из распространённых заболеваний, с которым сталкиваются все. Оно настолько часто встречается, что многие относятся к инфекции пренебрежительно, исключая родителей дошколят. С возрастом число простуд уменьшается, и люди забывают, каково это впервые лежать с температурой, заложенным носом и раздирающим горло кашлем. Малыши болеют по 8-10 раз за год, и каждая новая волна заболевания для них, как первая.
Малыши болеют по 8-10 раз за год, и каждая новая волна заболевания для них, как первая.
Под ОРВИ подразумевают множество заболеваний, поражающих верхние дыхательные пути и вызывающих общую интоксикацию организма. ОРВИ провоцируют различные вирусы, которые можно подтвердить только лабораторным анализом. Этиология заболевания связана как с возбудителями гриппа, так и с возбудителями, не относящимися к гриппозной этиологии. Вирусы проникают в организм через слизистую, после чего попадают в кровь, в которой происходит их активное размножение. По сравнению с коронавирусом, у которого схожая симптоматика, ОРВИ не поражает нервную и пищеварительную системы.
Читайте также Делать ли прививку от гриппа или написать отказ? Всё про вакцинацию детей и взрослых.
Как и когда заражаются дети?
Всемирную «популярность» этому заболеванию принёс способ передачи:
- воздушно-капельным путём;
- контактно-бытовым путём.
Заразиться можно через рукопожатие, поцелуи и просто пообщавшись с заражённым. Родителям и людям, проживающим в одном доме с детьми, нужно поберечь себя, чтобы не заражать маленьких домочадцев.
Родителям и людям, проживающим в одном доме с детьми, нужно поберечь себя, чтобы не заражать маленьких домочадцев.
Точной статистики по заболеваемости ОРВИ нет из-за того, что одни занимаются самолечением и остаются дома, другие — переносят простуду «на ногах», работая и не пропуская учебные занятия. Врач может судить об ОРВИ по количеству наблюдаемых пациентов, но многие в поликлинику обращаются не для того, чтобы получить лечение, а чтобы открыть больничный лист.
Отправляя больного ребёнка в детский сад или школу, вы ничем ему не помогаете, а заражаете других детей. Малыши болеют по несколько раз подряд: не успев оправиться от одной инфекции, они уже заражаются по новому кругу. Когда ребёнок не получает адекватного лечения, а вынужден идти в детский сад или на занятия, он тратит много сил, которые пошли бы на помощь иммунной системе.
ОРВИ болеют на протяжении всего года, но в «сырые» сезоны — с осени до весны — происходят вспышки массового заражения. В холодное время года люди подолгу остаются дома, из-за чего больше контактируют друг с другом. Поскольку передача вируса приходится на так называемую «зону дыхания», подразумевающую расстояние между людьми в 1 м, риск заражения резко возрастает. Эпидемиологи объясняют рост заболеваемости респираторными инфекциями тем, что при повышенной влажности и низкой температуре воздуха вирусы дольше сохраняются в окружающей среде.
Поскольку передача вируса приходится на так называемую «зону дыхания», подразумевающую расстояние между людьми в 1 м, риск заражения резко возрастает. Эпидемиологи объясняют рост заболеваемости респираторными инфекциями тем, что при повышенной влажности и низкой температуре воздуха вирусы дольше сохраняются в окружающей среде.
Риск заражения ОРВИ повышается в разы при:
- ослабленном иммунитете;
- влажной и холодной погоде;
- посещении людных мест.
ОРВИ в младенчестве и дошкольном возрасте
Малыши от 1 года до 5 лет подвержены риску частого заражения ОРВИ также, как и люди преклонного возраста. Новорождённые крайне редко простужаются, но если это случается из-за несовершенства защитных механизмов, болезнь протекает тяжело. Груднички в возрасте 3-6 месяцев находятся под защитой антител, полученных в период внутриутробного развития, а затем их иммунный ответ формирует грудное вскармливание.
В первые месяцы жизни кроха больше находится в кругу семьи, а после 1 года чаще контактирует с посторонними и другими детьми, поэтому риск заболеть у него становится выше. В детском саду вирус переходит от одного малыша к другому. До 5 лет ребёнок может болеть по несколько раз за год, благодаря чему у него вырабатывается специфический иммунитет, повышающий сопротивляемость к респираторным инфекциям. В 5-летнем возрасте и старше простуда всё реже одолевает организм.
В детском саду вирус переходит от одного малыша к другому. До 5 лет ребёнок может болеть по несколько раз за год, благодаря чему у него вырабатывается специфический иммунитет, повышающий сопротивляемость к респираторным инфекциям. В 5-летнем возрасте и старше простуда всё реже одолевает организм.
Симптомы при респираторных инфекциях
ОРВИ проявляется в виде:
- ухудшения общего состояния, слабости, вялости и сонливости;
- снижения или отсутствия аппетита;
- плаксивости, капризов;
- кашля;
- насморка;
- головной боли;
- озноба, жара.
Симптомы нарастают постепенно, проявляются все вместе или поочередно.
Не переживайте за здоровье и безопасность своего ребёнка даже в особо опасные периоды. Всегда знайте, где он находится сейчас или был в течение дня, с кем контактировал и кто его окружает, а также моментально связывайтесь в случае необходимости с помощью приложения «Где мои дети».
Сколько держится температура?
Норма, если температура при ОРВИ держится на отметке 38 ℃ в первые 3 дня. 5 суток — максимально допустимый срок, когда у ребёнка сильный жар. О высокой температуре на протяжении 5 и больше дней говорит присоединение другой бактериальной инфекции. Чтобы побороть инфекцию, понадобится курс антибиотиков, дозировку которых сможет подобрать только врач.
5 суток — максимально допустимый срок, когда у ребёнка сильный жар. О высокой температуре на протяжении 5 и больше дней говорит присоединение другой бактериальной инфекции. Чтобы побороть инфекцию, понадобится курс антибиотиков, дозировку которых сможет подобрать только врач.
Чем отличается грипп от ОРВИ?
Симптомы, по которым можно отличить респираторные заболевания друг от друга:
Чем отличается ОРВИ от коронавируса?
Сходств у этих острых респираторный вирусных инфекцией больше, чем отличий. ОРВИ развивается в течение 2-4 дней, тогда как COVID-19 — почти 2 недели. При коронавирусе чаще всего проявляется:
- лихорадка;
- сухой кашель;
- утомляемость;
- одышка;
- насморка практически нет;
- чихание отсутствует.
Читайте также Коронавирус у детей: риски заражения и первые признаки.
По сравнению с COVID-19 у ОРВИ:
- лихорадка бывает редко;
- кашель возникает, но симптом необязательный, и характер у него умеренный;
- утомляемость гораздо реже;
- нет никакой одышки;
- присутствует насморк и чихание.

Пропадает ли обоняние при ОРВИ?
Пропадает, потому что при ОРВИ чаще всего заложен нос, тогда как при коронавирусе насморк скорее редкость, чем характерный симптом. Больной ОРВИ не чувствует запахи из-за проблем с верхними дыхательными путями. Больной COVID-19 лишается обоняния не из-за того, что вирус поражает обонятельные нейроны, а воздействуют на клетки, отвечающие за метаболическую и структурную поддержку обонятельных сенсоров.
Возможные последствия после ОРВИ
75% всех случаев ОРВИ представляют собой вирусную инфекцию в чистом виде, а к оставшимся 25% присоединяется ещё и бактериальная инфекция, закладывающая «фундамент» для развития осложнений и появления хронических заболеваний. После выздоровления у ребёнка может проявляться остаточный кашель — бронхиальная гиперактивность, проявляющаяся при малейшем раздражении рецепторов ротоглотки, гортани, трахей и бронхов.
При остром течении болезни кашель действует как естественная защитная реакция организма. Он помогает очистить дыхательные пути, избавившись от мокроты, слизи и других раздражителей. Остаточный кашель сохраняется, если слизистые оболочки ротоглотки и гортани были сильно повреждены вирусами, из-за чего рецепторы остались в активном состоянии и продолжают реагировать на малейшие частицы пыли. После выздоровления кашель проявляется несколько дней, а иногда сохраняется на протяжении от 3 недель до 1,5 месяцев. Он отличается сухим или почти сухим характером, при этом температура тела не повышается, а с каждым днём кашель ослабевает и не мешает по ночам.
Он помогает очистить дыхательные пути, избавившись от мокроты, слизи и других раздражителей. Остаточный кашель сохраняется, если слизистые оболочки ротоглотки и гортани были сильно повреждены вирусами, из-за чего рецепторы остались в активном состоянии и продолжают реагировать на малейшие частицы пыли. После выздоровления кашель проявляется несколько дней, а иногда сохраняется на протяжении от 3 недель до 1,5 месяцев. Он отличается сухим или почти сухим характером, при этом температура тела не повышается, а с каждым днём кашель ослабевает и не мешает по ночам.
Агрессивные ОРВИ, к которым присоединилась бактериальная инфекция, провоцируют:
- обструктивную болезнь лёгких;
- бронхиальную астму;
- обструктивные бронхиты;
- аллергию;
- заболевания, вызванные грибковыми патогенами из-за неадекватной реакции иммунной системы.
Профилактика ОРВИ в детском возрасте
Малыши до 5 лет болеют чаще остальных, поэтому нуждаются в повышенном внимании взрослых.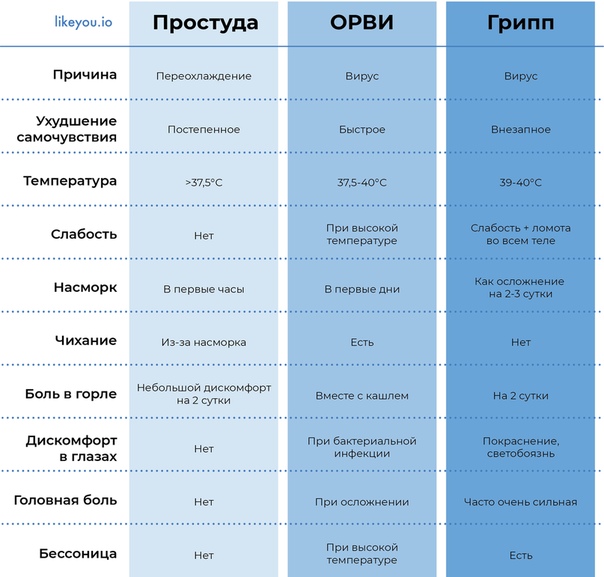 Не узнать в детстве, что такое ОРВИ, то же самое, что никогда не быть ребёнком. Избежать заболеваний не удастся, а вот минимизировать количество заражений возможно.
Не узнать в детстве, что такое ОРВИ, то же самое, что никогда не быть ребёнком. Избежать заболеваний не удастся, а вот минимизировать количество заражений возможно.
Соблюдайте меры профилактики, позволяющие укрепить иммунитет и тем самым повысить сопротивляемость организма к возбудителям. Они могут как побороть вирус, так и помочь ребёнку перенести заболевание в лёгкой форме, тогда как его ровесники с ослабленным иммунитетом будут испытывать полный «букет» симптомов.
Меры профилактики, укрепляющие иммунную систему от простуд и ОРВИ:
- вводите в рацион сезонные овощи и фрукты;
- ежедневно проветривайте комнаты и делайте влажную уборку;
- занимайтесь физкультурой;
- исключайте контакты с болеющими родственниками;
- мойте руки по возвращению с улицы и перед употреблением пищи;
- ограничьте посещение многолюдных мест;
- поддерживайте в помещение температуру 18-22о;
- полноценно питайтесь;
- проходите вакцинацию перед сезоном массовых простуд;
- соблюдайте режим сна и бодрствования;
- чаще гуляйте на улице.

Каждая семья может внедрить в свою жизнь эти простые правила. Если их придерживаться, вы обезопасите детей от простудных заболеваний.
Как лечить ОРВИ у детей?
Не ставьте эксперименты над ребёнком и сразу обращайтесь к врачу. Инкубационный период ОРВИ длится 2-4 дня, на протяжении которых вирусы активно размножаются и атакуют иммунную систему. Чтобы не довести до осложнений, обеспечьте ребёнка:
- постельным режимом;
- изоляцией от контакта с другими детьми;
- обильным питьём;
- легкоусвояемым белковым питанием;
- витамином C.
Появившийся признак ОРВИ сигнализирует об изменении дневного режима: вместо энергичных игр на свежем воздухе останьтесь дома. Неизрасходованные силы помогут ребёнку бороться с повышением температуры и поскорее выздороветь. Минимизировав контакты с друзьями, вы сократите распространение вируса среди детей.
Давайте ребёнку обильное тёплое питье, благодаря которому организм не столкнётся с обезвоживанием и сможет быстрее избавиться от токсинов через пот и мочу. Белковая еда восстанавливает потраченные силы, а продукты, богатые витамином C, ускоряют деление T-клеток, которые противостоят инфекциям.
Белковая еда восстанавливает потраченные силы, а продукты, богатые витамином C, ускоряют деление T-клеток, которые противостоят инфекциям.
Читайте также Витамины для детей: отличная память, хорошее настроение и зима без простуды.
Какие лекарства можно давать ребёнку при ОРВИ?
Респираторные вирусные инфекции лечат в двух направлениях:
- симптоматической терапией;
- противовирусными препаратами.
Чтобы убрать симптомы при ОРВИ у детей, используют следующие средства:
Кашель
Назначают препараты в форме сиропов на растительной основе, с содержанием амброксола или бромгексина. Грудничкам назначают сиропы «Амбробене» и «Бромгексин», детям старше 2-х лет — препарат «Коделак бронхо», в основе которого экстракт чабреца и амброксол.
Боль в горле
Леденцы и спреи с анестетиками.
Заложенность носа
Слизистую оболочку носа очищают и увлажняют солевыми растворами «Отривин» и «Аквалор», предназначенными для детей с рождения.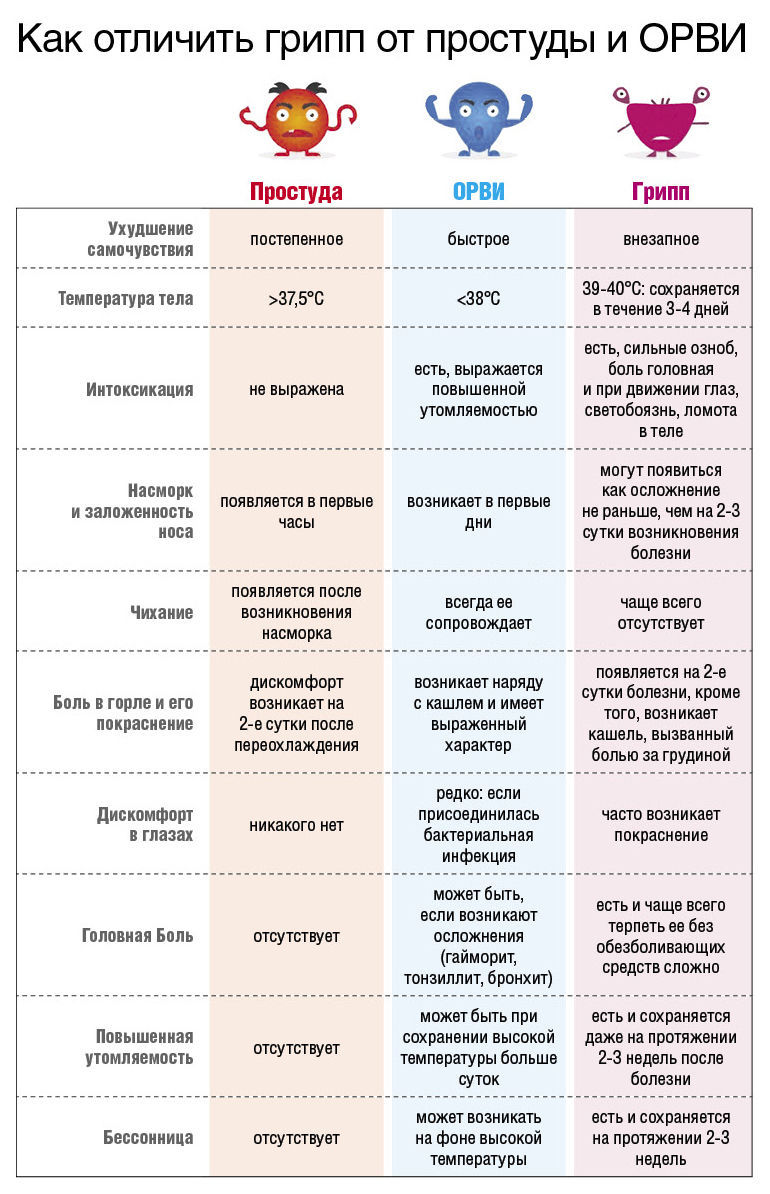 Препарат с оксиметазолином сужает сосуды, снижает отёк слизистой и облегчает дыхание.
Препарат с оксиметазолином сужает сосуды, снижает отёк слизистой и облегчает дыхание.
Важно! Длительно используя капли можно повредить слизистую носа.
Высокая температура
Малышам легче давать жаропонижающие препараты с парацетамолом и ибупрофеном, выпущенные в виде сиропа. С первого месяца жизни можно использовать Эффералган и Нурофен, с 3 месяцев — Панадол.
Перечисленные препараты ослабевают симптомы, но никак не воздействуют на причину заболевания.
Иммуномоделирующие и противовирусные средства борются непосредственно с возбудителем гриппа и ОРВИ. Выявив острые респираторные инфекции, врач предписывает:
- прямые этиотропные на основе римантадина, действующие против вируса гриппа A, и на основе осельтамивира, работающие против гриппа A и B. Чаще назначают Арбидол и другие препараты умифеновира, которые оказывают прямое действие на все разновидности возбудителей гриппа и ОРВИ;
- инфетрферон и его индукторы относятся к противовирусным препаратам широкого спектра действия.
 Детям младше 1 года назначают суппозитории «Виферон», «Генферон», «Кипферон» и капли «Гриппферон», которые входят в подгруппу природных и рекомбинантных препаратов интерферона. Синтетические производные интерферона имеют ограничения по возрасту. К примеру, Кагоцел и Полиоксидоний нельзя давать малышам до 3-х лет;
Детям младше 1 года назначают суппозитории «Виферон», «Генферон», «Кипферон» и капли «Гриппферон», которые входят в подгруппу природных и рекомбинантных препаратов интерферона. Синтетические производные интерферона имеют ограничения по возрасту. К примеру, Кагоцел и Полиоксидоний нельзя давать малышам до 3-х лет; - иммуномодуляторы назначают в целях профилактики;
- релиз-активные препараты недостаточно изучены, поэтому их нужно выбирать с осторожностью. Использование индукторов эндогенного интерферона имеет ограничения по возрасту: капли «Анаферон» с 1 месяца, таблетки «Эргоферон» с полугода.
Дети заражаются ОРВИ по 8-10 раз за год, и по мере взросления всё реже болеют за счёт сформировавшегося иммунитета. ОРВИ нельзя запускать, чтобы не возникли осложнения.
Читайте также:
Простуда у ребёнка: как лечить ее правильно
Многие родители готовы к тому, что малыши будут подхватывать распространенные, в том числе сезонные инфекции, что характерно именно для детского возраста..gif) Некоторые родители заранее изучают методы лечения ОРВИ и простуд, читают об этом у опытных мамочек в блогах и дневниках, советуются со знакомыми врачами, смотрят медицинские программы. Но даже, несмотря на то, что организм ребенка с рождения обладает мощной иммунной системой, защита эта несовершенна. Поэтому как бы мама не была информирована, когда ребенок заболевает, у нее возникает масса вопросов, на которые требуются квалифицированные ответы.
Некоторые родители заранее изучают методы лечения ОРВИ и простуд, читают об этом у опытных мамочек в блогах и дневниках, советуются со знакомыми врачами, смотрят медицинские программы. Но даже, несмотря на то, что организм ребенка с рождения обладает мощной иммунной системой, защита эта несовершенна. Поэтому как бы мама не была информирована, когда ребенок заболевает, у нее возникает масса вопросов, на которые требуются квалифицированные ответы. Что такое ОРЗ и ОРВИ
Чаще всего дети сталкиваются с острыми респираторными заболеваниями, именуемыми сокращенно ОРЗ или простудами. Особенно это проявляется при посещении детских коллективов, где они контактируют с другими малышами, и фактически обмениваются различными возбудителями. Мамам «детсадовских» ребятишек очень хорошо знакома фраза: «2 дня ходим, потом 2 недели — на больничном».
Простуда бывает как вирусной, так и бактериальной, даже грибковой и другой природы, в 70-80% случаях носит именно вирусный характер.
 Установить на педиатрическом осмотре происхождение простуды с точностью невозможно, как и «на глазок» отличить одну инфекцию от другой. Однако есть определенные признаки, указывающие на действие вирусов, вредных бактерий и прочих возбудителей. Например, слизистые носовые выделения свидетельствуют в пользу острой респираторной вирусной инфекции, которая обычно начинается с легкого недомогания, снижения аппетита, капризности, нарушения сна у ребенка. Это продромальный период, он длится от нескольких часов до 1-2 дней. А такая вирусная инфекция как грипп начинается остро, сразу с очень высокой температуры, интоксикации, продромального периода почти нет, сухой кашель появляется в поздние сроки болезни. Часто ОРВИ проходит с катаральными симптомами: заложенность носа, изменение оттенка голоса, «круги», «синева» под глазами, насморк, отделяемое из носа, кашель, боли в горле и при глотании.
Установить на педиатрическом осмотре происхождение простуды с точностью невозможно, как и «на глазок» отличить одну инфекцию от другой. Однако есть определенные признаки, указывающие на действие вирусов, вредных бактерий и прочих возбудителей. Например, слизистые носовые выделения свидетельствуют в пользу острой респираторной вирусной инфекции, которая обычно начинается с легкого недомогания, снижения аппетита, капризности, нарушения сна у ребенка. Это продромальный период, он длится от нескольких часов до 1-2 дней. А такая вирусная инфекция как грипп начинается остро, сразу с очень высокой температуры, интоксикации, продромального периода почти нет, сухой кашель появляется в поздние сроки болезни. Часто ОРВИ проходит с катаральными симптомами: заложенность носа, изменение оттенка голоса, «круги», «синева» под глазами, насморк, отделяемое из носа, кашель, боли в горле и при глотании. Что делать?
В первую очередь нужно запомнить, что родителям не стоит паниковать, если у ребенка поднялась температура и возникли прочие неприятные симптомы простуды.
 Любое настроение матери передается малышу. Простуда при грамотном подходе просто ОБЯЗАНА пройти за 5-7 дней без осложнений. И важно знать, что лечение простуды является комплексным, куда входят основные препараты – противовирусные, антибактериальные и пр., а также средства симптоматической терапии. Не стоит надеяться только на одно какое-то лекарство, как на панацею, волшебную пилюлю из рекламы или совета работника аптеки.
Любое настроение матери передается малышу. Простуда при грамотном подходе просто ОБЯЗАНА пройти за 5-7 дней без осложнений. И важно знать, что лечение простуды является комплексным, куда входят основные препараты – противовирусные, антибактериальные и пр., а также средства симптоматической терапии. Не стоит надеяться только на одно какое-то лекарство, как на панацею, волшебную пилюлю из рекламы или совета работника аптеки. Как лечить?
Противовирусные препараты. Сейчас встречается много недостоверной информации в отношении противовирусных препаратов. Им приписывают мифические побочные эффекты и действия. Если такое исходит от врача, то он должен предоставить подтверждающие его точку зрения данные в официальных источниках, которыми являются государственные медицинские учреждения, крупные научные журналы.
Антибиотики. Что касается антибиотиков, то в настоящее время их применение ограничено очень четкими показаниями, противопоказаниями, возрастом больного и т. д. Кроме того, антибиотики, особенно при бесконтрольном, частом применении, способствуют образованию новых, трудно поддающихся лечению штаммов вредных бактерий. Обычно на фоне лечения антибиотиками принято назначать биопрепараты – живые микробы, составляющие кишечной микрофлоры человека. Но существует мнение, что антибиотик губительно действует и на эти бактерии и такая терапия не приносит желаемого результата.
д. Кроме того, антибиотики, особенно при бесконтрольном, частом применении, способствуют образованию новых, трудно поддающихся лечению штаммов вредных бактерий. Обычно на фоне лечения антибиотиками принято назначать биопрепараты – живые микробы, составляющие кишечной микрофлоры человека. Но существует мнение, что антибиотик губительно действует и на эти бактерии и такая терапия не приносит желаемого результата.
Вспомогательные средства. В лечении простуды любого происхождения используются средства симптоматической терапии, действие которых направлено против симптомов болезни. Они называются вспомогательными, так как именно помогают облегчить течение простуды. Они не избавляют от причины ОРВИ, а против вирусов работают собственные антитела ребенка.
Чем лечить насморк? При насморке проводят туалет носа с солевыми растворами. Процедура простая, но требует определенных навыков и осторожности. Для этого следует усадить ребенка к себе спиной, предварительно очистить ему нос. У малышей это можно сделать при помощи ватных палочек (у детей до полугода только обычными ватными турундочками), а в старшем возрасте дети уже могут сами высмаркиваться. После этого нужно приподнять подбородок, удерживая лицо ребенка своей ладонью в приподнятом состоянии. С помощью пипетки закапать в оба носовые хода солевой раствор, опустить голову ребенка вперед. Из носа может вылиться часть лекарства, но результат такой процедуры все равно будет достигнут. Если особых рекомендаций педиатра заболевшего ребенка нет, можно пользоваться пипеткой и обычным физиологическим раствором. Но предпочтительнее стерильным раствором на основе морской воды. Заблуждение думать, что промывание носа ребенка вызовет привыкание или сопли сами вытекут. Часть, конечно, может вытечь наружу, но если не очищать нос, высок риск распространения инфекции в ниже лежащие дыхательные пути, развития таких осложнений, как воспаление трахеи, бронхов, легких.
У малышей это можно сделать при помощи ватных палочек (у детей до полугода только обычными ватными турундочками), а в старшем возрасте дети уже могут сами высмаркиваться. После этого нужно приподнять подбородок, удерживая лицо ребенка своей ладонью в приподнятом состоянии. С помощью пипетки закапать в оба носовые хода солевой раствор, опустить голову ребенка вперед. Из носа может вылиться часть лекарства, но результат такой процедуры все равно будет достигнут. Если особых рекомендаций педиатра заболевшего ребенка нет, можно пользоваться пипеткой и обычным физиологическим раствором. Но предпочтительнее стерильным раствором на основе морской воды. Заблуждение думать, что промывание носа ребенка вызовет привыкание или сопли сами вытекут. Часть, конечно, может вытечь наружу, но если не очищать нос, высок риск распространения инфекции в ниже лежащие дыхательные пути, развития таких осложнений, как воспаление трахеи, бронхов, легких.
Если насморк обильный, водянистый, мучительный, сопровождается заложенностью носа, применяют сосудосуживающие препараты (на основе оксиметазолина, ксилометазолина) в виде капель перед сном, перед прогулкой с ребенком. Это помогает малышу хорошо отдохнуть во сне, не просыпаясь, а на прогулке нормально дышать носом, не захватывая ртом холодный воздух. Не следует проводить закапывания в нос ребенку в лежачем состоянии, поскольку высока вероятность изменения давления при такой манипуляции и есть риск возникновения отита. Все закапывания необходимо проводить сидя. Использование специальных препаратов в виде софта (спрей с ограниченным давлением струи) следует проводить с большой осторожностью, поскольку тоже есть риск под давлением способствовать распространению инфекции.
Это помогает малышу хорошо отдохнуть во сне, не просыпаясь, а на прогулке нормально дышать носом, не захватывая ртом холодный воздух. Не следует проводить закапывания в нос ребенку в лежачем состоянии, поскольку высока вероятность изменения давления при такой манипуляции и есть риск возникновения отита. Все закапывания необходимо проводить сидя. Использование специальных препаратов в виде софта (спрей с ограниченным давлением струи) следует проводить с большой осторожностью, поскольку тоже есть риск под давлением способствовать распространению инфекции.
Жаропонижающие средства. Зачастую возникают вопросы по поводу применения жаропонижающих средств, для детей – это препараты на основе парацетамола или ибупрофена, для малышей — в сиропе, свечах. Следует отметить, что если нет особых рекомендаций на этот счет, снижать необходимо температуру выше 38,3 – 38,5°С. Если ребенок чувствует себя неплохо, играет, сохранен аппетит, и, вообще, температуру переносит хорошо, жаропонижающее препараты можно не применять. Если родители видят, что состояние ребенка плохое, он отказывается от еды и питья, становится вялым, возникает рвота, головная боль, температура повышается дальше, можно начать давать жаропонижающие и при невысокой температуре.
Если родители видят, что состояние ребенка плохое, он отказывается от еды и питья, становится вялым, возникает рвота, головная боль, температура повышается дальше, можно начать давать жаропонижающие и при невысокой температуре.
Как лечить кашель? Вопросы про кашель являются самыми частыми и порой самыми сложными на педиатрическом приеме по поводу ОРВИ. Лучше всего, если врач динамически наблюдает кашляющего ребенка. При этом специалист может отличить изменения оттенка голоса, лающий компонент, сухой или влажный кашель, хрипы, локализацию хрипов. Если педиатр рекомендует сделать рентгеновский снимок, не следует отказываться от такого обследования, это поможет поставить правильный диагноз и назначить адекватное лечение. В настоящее время при лечении кашля широко применяются ингаляционные препараты – через специальный прибор – ингалятор. Такая тактика снижает системное воздействие лекарства на организм ребенка, где препарат достигает точки своего приложения — крупных и средних бронхов, и даже альвеол. Ингаляторы можно использовать с самого рождения ребенка, но необходимо обратить внимание на тип прибора, рекомендованные для него лекарственные вещества, их дозировки и кратность применения.
Ингаляторы можно использовать с самого рождения ребенка, но необходимо обратить внимание на тип прибора, рекомендованные для него лекарственные вещества, их дозировки и кратность применения.
Действия до прихода врача
Иногда, особенно в сезон высокой заболеваемости гриппом и простудой, возникают затруднения с визитом врача, приходится ждать приема, врач не успевает прийти так быстро, как хотелось бы родителям. Есть такие меры, которые можно предпринять до прихода специалиста. Нужно померить температуру ребенку и данные о проведенной термометрии записать в дневничок, который затем показать доктору. Если температура высокая, не следует кутать или даже тепло одевать ребенка. Дома вообще можно раздеть до нижнего белья. Одноразовый подгузник с младенцев тоже рекомендовано снять. Не стоит забывать про физические методы охлаждения — можно обтирать прохладной водой, на голову, живот, места магистральных сосудов можно положить смоченную водой ткань. Следует обильно дробно поить заболевшего ребенка, даже если отказывается пить, необходимо постоянно предлагать из чайной ложечки, смачивать губы.
Следует обильно дробно поить заболевшего ребенка, даже если отказывается пить, необходимо постоянно предлагать из чайной ложечки, смачивать губы.
Не бывает ребятишек, которые не болеют. Болеют все, только одни часто, а другие не очень. Главное помнить, что любые лекарственные средства должны назначаться врачом на очном приеме, после осмотра.
признаки, симптомы, лечение и профилактика
Грипп – это тяжелая вирусная инфекция, которая поражает мужчин, женщин и детей всех возрастов и национальностей. Эпидемии гриппа случаются каждый год обычно в холодное время года. По количеству случаев в мире грипп и ОРВИ занимают первое место, удельный вес в структуре инфекционных заболеваний достигает 95%.
Грипп и ОРВИ, постепенно подрывая здоровье, сокращают на несколько лет среднюю продолжительность жизни человека. При тяжелом течении гриппа часто возникают необратимые поражения сердечно-сосудистой системы, дыхательных органов, центральной нервной системы, провоцирующие заболевания сердца и сосудов, пневмонии, трахеобронхиты, менингоэнцефалиты.
Наибольшие жертвы грипп собирает среди пожилых групп населения, страдающих хроническими болезнями.
Вирус гриппа очень легко передается:
- Самый распространенный путь передачи инфекции — воздушно-капельный.
- Также возможен и бытовой путь передачи, например, через предметы обихода.
Что такое ОРВИ? В чём отличие от гриппа?
Термин «острое респираторное заболевание» (ОРЗ) или «острая респираторная вирусная инфекция» (ОРВИ) охватывает большое количество заболеваний, во многом похожих друг на друга. Основное их сходство состоит в пути передачи (проникают в организм вместе с вдыхаемым воздухом через рот и носоглотку) и в наборе симптомов:
- У больного несколько дней отмечается повышенная температура тела, воспаление в горле, кашель, озноб, боль в мышцах и головная боль.

- Самым распространенным симптомом респираторных заболеваний является насморк; он вызывается целым рядом родственных вирусов, известных как риновирусы.
В основном возбудители острых респираторных инфекций передаются от человека к человеку через кашель или чихание больного. Любой человек, близко (приблизительно на расстоянии 1 метра) контактирующий с другими человеком с симптомами ОРВИ подвергается риску воздействия потенциально инфекционных вдыхаемых капель. Вирусы могут попасть в организм (в глаза, нос или рот) через руки при соприкосновении с инфицированной поверхностью.
С помощью соблюдения личной гигиены можно предупредить распространение возбудителей, вызывающих респираторные инфекции.
| Признаки и симптомы гриппа | Признаки и симптомы ОРВИ |
|
|
Различия между коронавирусом COVID-19, простудой и гриппом
Как известно, новая коронавирусная инфекция COVID-19 передается преимущественно воздушно-капельным путем. Ей характерно наличие клинических симптомов ОРВИ (вы можете ознакомиться с подробным ликбезом от Севздрава по ссылке — https://sevdz.ru/mednavigator/profilaktika/koronavirus/).
Важно! COVID-19 иногда протекает бессимптомно, но от этого носитель вируса не становится менее заразным. Особенно в таких случаях страдают люди с хроническими заболеваниями.
Особенно в таких случаях страдают люди с хроническими заболеваниями.
Наглядная инфографика от Роспотребнадзора:
Основные рекомендации по профилактике гриппа и ОРВИ для населения
Меры профилактики особенно важно соблюдать сейчас — в период пандемии новой коронавирусной инфекции.
Режим самоизоляции отменен, но пандемия никуда не исчезла! Нам всем необходимо думать о своем здоровье и здоровье окружающих людей.
- Избегайте близкого контакта с людьми, которые кажутся нездоровыми, обнаруживают явления жара (температуры) и кашель.
- Избегать многолюдных мест или сократить время пребывания в многолюдных местах.
- Стараться не прикасаться ко рту и носу.
- Соблюдать гиену рук – чаще мыть руки водой с мылом или использовать средство для дезинфекции рук на спиртовой основе, особенно в случае прикосновения ко рту, носу.
- Увеличить приток свежего воздуха в жилые помещения, как можно чаще открывать окна.

- Используйте маски при контакте с больным человеком.
- Придерживайтесь здорового образа жизни, включая полноценный сон, употребление «здоровой» пищи, физическую активность.
Профилактическая иммунизация населения (вакцинация) – самая лучшая профилактика гриппа. В свою очередь, самая главная опасность отказа от вакцинации – это возможность заболеть гриппом при контакте с заболевшем человеком. Кроме того, человек, не прошедший вакцинацию, потенциально опасен для окружающих, так как является вероятным переносчиком инфекционного заболевания.
Подробно: зачем нужна вакцинация и где сделать прививку от гриппа в Севастополе.
Рекомендации для лиц с симптомами ОРВИ
- При плохом самочувствии оставаться дома и выполнять рекомендации врача, по возможности держаться от здоровых людей на расстоянии (1 метр).
- Отдыхать и принимать большое количество жидкости.

- Закрывать рот и нос при кашле или чихании носовым платком или другими пригодными для этой цели материалами. Утилизировать этот материал сразу после использования или стирать его. Мойте руки сразу после контакта с выделениями из дыхательных путей!
- Необходимо носить маску, если находитесь на общей территории дома поблизости от других людей.
- Сообщите своим близким и друзьям о болезни.
Важно! Медицинские маски
Рекомендации по использованию защитных медицинских масок:
- Ношение медицинских масок обязательно для лиц, имеющих тесный контакт с больным пациентом.
- Аккуратно надевайте маску так, чтобы она закрывала рот и нос, и крепко завязывайте ее так, чтобы щелей между лицом и маской было, как можно меньше.
- При использовании маски старайтесь не прикасаться к ней.
- Прикоснувшись к использованной маске, например при снятии, вымойте руки водой с мылом или с использованием средств для дезинфекции рук на спиртовой основе.

- Заменяйте используемую маску на новую чистую, сухую маску, как только используемая маска станет сырой (влажной).
- Не следует использовать повторно маски, предназначенные для одноразового использования.
- Выбрасывайте одноразовые маски после каждого использования и утилизируйте их сразу после снятия.
Рекомендации по уходу за больным в домашних условиях
- Изолируйте больного от других, по крайней мере, на расстоянии не менее 1 метра от окружающих.
- Прикрывайте свой рот и нос при осуществлении ухода за больным с использованием масок.
- Тщательно мойте руки водой с мылом после каждого контакта с больным. Выделите отдельные полотенца каждому члену семьи.
- Кроме лиц, осуществляющих уход, больного не должны посещать другие посетители.
- По возможности, только один взрослый в доме должен осуществлять уход за больным.

- Избегайте того, чтобы за больным ухаживала беременная женщина.
- Постоянно проветривайте помещение, в котором находится больной.
- Содержите помещение в чистоте, используя моющие средства.
Рекомендации для родителей заболевших детей
- При заболевании ребенка обратитесь за медицинской помощью к врачу.
- Оставляйте больного ребенка дома, кроме тех случаев, когда ему нужна медицинская помощь.
- Давайте ребенку много жидкости (сок, воду).
- Создайте ребенку комфортные условия, крайне важен покой.
- Если у ребенка жар, боль в горле и ломота в теле, вы можете дать ему жаропонижающие средства, которые пропишет врач с учетом возраста пациента.
- Держите салфетки и корзину для использованных салфеток в пределах досягаемости больного.
- Научите детей часто мыть руки с мылом в течение 20 секунд. Родители тоже должны выполнять эту процедуру, что послужит хорошим примером для детей.

- Научите детей кашлять и чихать в салфетку или в руку. Родители тоже должны выполнять эту процедуру, что послужит хорошим примером для детей.
- Научите детей не подходить к больным ближе, чем на полтора-два метра.
- Заболевшие дети должны оставаться дома (не посещать дошкольные учреждения и школы), а также держаться на расстоянии от других людей, пока их состояние не улучшится.
- Воздержитесь от частых посещений мест скопления людей.
- Если ребенок имел контакт с больным гриппом, спросите у врача необходимость приема антивирусных лекарств для предупреждения заболевания.
/upload/iblock/8fb/8fb3203939955ff7f105f494ffa830a6.pngКод PHP» data-counter>
Как отличить грипп от ОРВИ у ребенка
02. 11.2016
11.2016
Нередко детский организм сталкивается с различными инфекциями. Потому мамы хотят знать особенности течения разных недугов, чтобы понимать, как действовать в случившейся ситуации. У многих возникает вопрос: как отличить грипп от ОРВИ у ребенка, ведь известно, что вирусными инфекциями часто болеют именно дети?
Что такое ОРВИ и грипп?
ОРВИ — это не название конкретной болезни. Таким термином называют все те поражения дыхательных путей, которые имеют вирусную природу, сюда же относится и грипп. Но его чаще всего рассматривают, как отдельное заболевание.
Можно назвать главные отличия простых ОРВИ от гриппа у детей:
При гриппе состояние ухудшается стремительно, в то время как при обычных вирусных инфекциях симптомы нарастают постепенно.
При гриппе температура за 2 часа становится выше 39°С. Жар при этом сбивается плохо, а такое состояние способно сохраняться несколько дней. При ОРВИ обычно температура не превышает 38,5°С и за 2-3 суток нормализуется.
При простуде ребенок жалуется на недомогание, быстро устает. Для гриппа же характерны сильная головная боль, покраснение глаз и слабость в теле, кашель появляется не с начала заболевания, в то время как ОРВИ он сопровождает с первого дня. Насморк является верным спутником ОРВИ, малыши чихают. Для гриппа такие признаки не характерны. Нос у больных закладывает не так сильно и проходит этот симптом уже на 2 сутки. Сильный насморк может возникнуть, если у ребенка есть хронические заболевания носоглотки.
Также отличием в симптомах гриппа и ОРВИ у детей является наличие или, наоборот, отсутствие расстройств ЖКТ. При простуде рвота и жидкий стул встречаются крайне редко. При гриппе у ребенка возможны кишечные расстройства.
При обычных вирусных инфекциях часто можно заметить увеличение лимфатических узлов, красное горло имеет рыхлую структуру, возможен налет на слизистых. Для гриппа такие признаки не характерны. При этом недуге горло может краснеть и отекать, но оно не бывает рыхлым.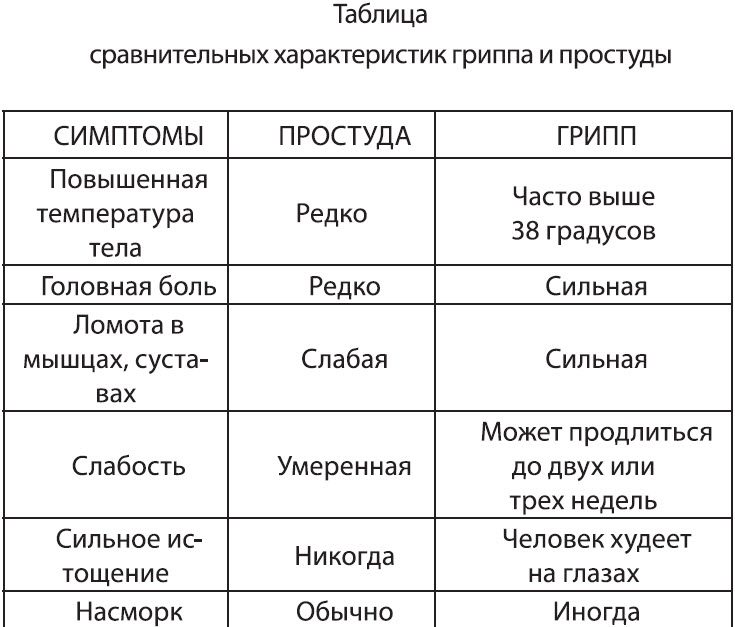
Простуда заканчивается без последствий, через 7-10 дней больной уже может вести обычный образ жизни. После гриппа больной ослабленный, могут быть головокружения, плохой аппетит, понижение или повышение артериального давления, раздражительность, бессонница. Период выздоровления гриппа длиться около 3-4 недель и опасен «второй волной» заболевания.
При возникновении симптомов у вашего ребенка, похожих на грипп или простуду обращайтесь к врачу-педиатру — он точно определит причину болезни и назначит эффективное и безопасное лечение.
ОРВИ — причины, симптомы и лечение
С диагнозом ОРВИ каждый из нас сталкивался в жизни не раз. Эта аббревиатура расшифровывается как острая респираторная вирусная инфекция. В народе же болезнь попросту называют простудой.
ОРВИ объединяет целый ряд воспалительных заболеваний, для которых характерны следующие признаки:
- возбудитель – вирус;
- воздушно-капельный путь заражения;
- первоочередное поражение органов дыхания;
- стремительное развитие и острое течение заболевания, которое само по себе длится сравнительно недолго.

У вас появились симптомы ОРВИ?
Точно диагностировать заболевание может только врач. Не откладывайте консультацию — позвоните по телефону +7 (495) 775-73-60Что нужно знать о болезни:
- ОРВИ провоцируют вирусы парагриппа, риновирусы, реовирусы, аденовирусы и многие другие, всего более 200 видов.
- Все они легко передаются воздушно-капельным путем, а также при телесном контакте. С момента заражения до развития болезни проходит относительно мало времени, около 2 дней.
- При дыхании и чихании больные выделяют в воздух возбудителей, которые попадают на слизистую оболочку верхних дыхательных путей здоровых людей, оседают там и начинают продуцировать токсины. Они разносятся по всему организму и вызывают общую интоксикацию, проявляющуюся в виде головных болей, повышенной температуры, ломоты в суставах и мышцах. Возникают и респираторные симптомы: насморк, кашель, боль в горле.

- В острый период развития болезни человек чувствует себя разбитым, не способным полноценно трудиться.
Факторы риска
Чаще всего ОРВИ болеют дети, поскольку их иммунная система еще формируется. Болезнь может протекать довольно тяжело, нередко возникают осложнения. Взрослые, как правило, болеют реже, порой у них даже не повышается температура. Но если ОРВИ диагностировали несколько раз за сезон, нужно бить тревогу. Следует обратиться к врачу и пройти дополнительные обследования.
Многие относятся к этому вирусному заболеванию несерьезно, переносят его на ногах, продолжают ходить на работу даже когда повышается температура. Однако пренебрегать вирусной инфекцией не стоит. Во-первых, больной человек заражает окружающих. Во-вторых, ОРВИ на ногах чревата серьезными осложнениями, такими как отит, синусит, миокардит, пневмония, менингит, то есть на базе вирусной инфекции развивается бактериальная. Лечение этих заболеваний длительное и дорогостоящее, нередко показана госпитализация. Особенно опасны ОРВИ для людей, которые имеют хронические заболевания, ослабленный иммунитет, много работают и неполноценно питаются.
Во-вторых, ОРВИ на ногах чревата серьезными осложнениями, такими как отит, синусит, миокардит, пневмония, менингит, то есть на базе вирусной инфекции развивается бактериальная. Лечение этих заболеваний длительное и дорогостоящее, нередко показана госпитализация. Особенно опасны ОРВИ для людей, которые имеют хронические заболевания, ослабленный иммунитет, много работают и неполноценно питаются.
Осложнения
Сколько дней длится ОРВИ? Обычно острый период вирусного заболевания проходит через 3-4 дня, симптомы постепенно исчезают, боль в горле проходит, уменьшается насморк. Но если через 7 дней с начала болезни симптоматика продолжает оставаться ярко выраженной, не исключено появление осложнения. Вирус активно размножается в дыхательных путях, угнетая мерцательный эпителий, выступающий своеобразным фильтром легких.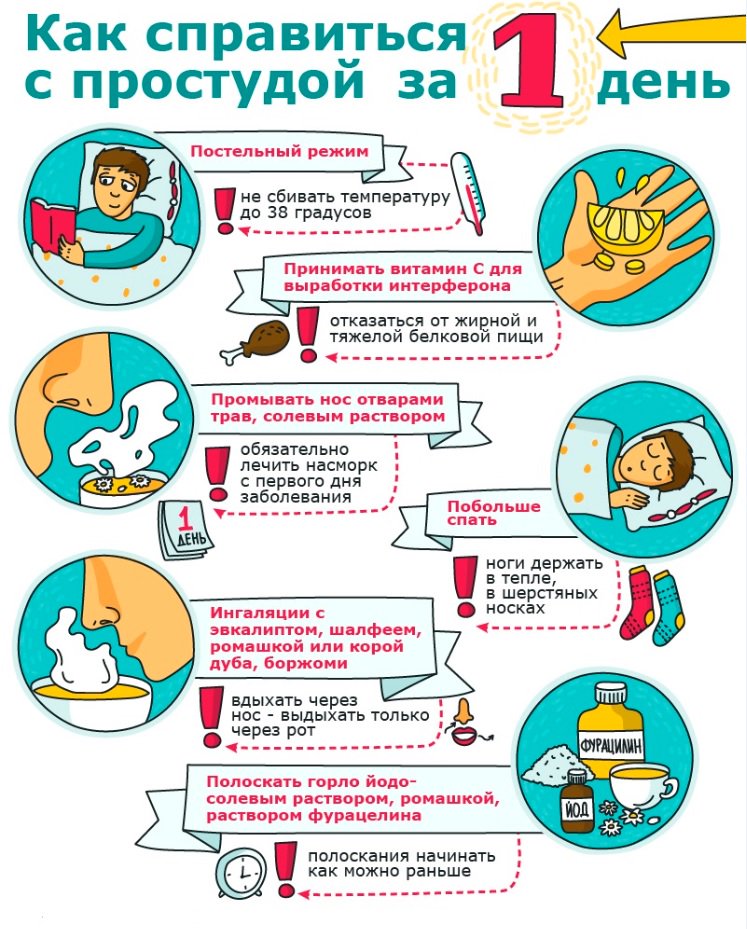 Поэтому в этот период другие вирусы и бактерии могут беспрепятственно проникать в легкие и иные органы. Нередко осложнения проходят без всяких симптомов, но они коварны вдвойне, поскольку сильно понижают иммунитет.
Поэтому в этот период другие вирусы и бактерии могут беспрепятственно проникать в легкие и иные органы. Нередко осложнения проходят без всяких симптомов, но они коварны вдвойне, поскольку сильно понижают иммунитет.
После ОРВИ медики могут констатировать развитие многих серьезных заболеваний.
- Наиболее частый диагноз – бронхит, воспалительный процесс в бронхах. Он сопровождается глубоким кашлем, одышкой, повышенным потоотделением. При этом температура повышается не всегда, а кашель, вначале сухой, надрывный, со временем переходит в мокрый. В крайних случаях развивается гнойный бронхит.
- Гайморит – воспаление гайморовых пазух. Подозрение на него возникает, когда пациент жалуется на ноющую головную боль, постоянную заложенность носа, нарушение носового дыхания, выделения. Температура держится на уровне 37°. Если не лечиться, инфекция может распространиться дальше, что особенно опасно для детей. У взрослых острое состояние может перейти в хроническую форму.

- Одно из наиболее опасных осложнений – пневмония, воспаление легочной ткани. Ее симптоматика (кашель, одышка) схожа с бронхитом, но температура держится дольше, наблюдается общий упадок сил. Для подтверждения подозрения на пневмонию назначается рентгенологическое исследование. Лечение занимает весьма длительное время, применяются сильные антибиотики, показана госпитализация.
- Миокардит – воспаление сердечной мышцы (миокарда). Нередко возникает даже после ОРВИ, протекающей в легкой форме. Проявляется общей слабостью, одышкой, нарушением ритма сердца. Без надлежащего лечения грозит хроническими сердечными заболеваниями.
- Когда инфекция из носа перемещается в сторону уха, может появиться отит – воспаление слизистой оболочки среднего уха и барабанной перепонки. В остром периоде возникает сильная боль, повышается температура. Без полноценного лечения слух ухудшается, а при повреждении слухового нерва может пропасть совсем.
- Опасным осложнением ОРВИ является пиелонефрит – воспалительный процесс в почках, характерными признаками которого являются боли в области поясницы.
 Однако у взрослых это заболевание может проходить и без симптомов. Диагностируют его по анализу мочи, показывающему повышенное содержание лейкоцитов.
Однако у взрослых это заболевание может проходить и без симптомов. Диагностируют его по анализу мочи, показывающему повышенное содержание лейкоцитов. - Смертельно опасным осложнением может оказаться менингит – воспаление оболочек головного или спинного мозга.
Подготовка к посещению/визиту врача
Если ОРВИ развиваются у детей, родители вызывают врача на дом или обращаются в поликлинику. Но большинство взрослых игнорируют простуду. В лучшем случае лечатся дома, в худшем – по совету знакомых или телерекламы принимают лекарства и продолжают ходить на работу. В итоге по вине самостоятельно назначенных препаратов возникают хронические патологии, осложнения, аллергии, кишечные расстройства.
ОРВИ не так безопасна, как кажется из-за ее последствий. Врачи настоятельно рекомендуют бороться с ней под контролем специалистов и не заниматься самолечением.
Врачи настоятельно рекомендуют бороться с ней под контролем специалистов и не заниматься самолечением.
Особенно коварны простуды по отношению к пожилым людям и лицам с хроническими заболеваниями. ОРВИ вызывают разные вирусы, в каждом случае проявляющие себя по-иному. Поставить точный диагноз и подобрать правильную схему лечения способен только врач. Человек может вызвать терапевта на дом, если сам не может прийти на прием из-за таких симптомов:
- температуры 38° и выше;
- совокупных признаков ОРВИ и гриппа в период эпидемий;
- сильных болей в позвоночнике и суставах;
- повышенного или пониженного артериального давления, головокружения;
- сильной тошноты и рвоты, диареи.
Если наблюдается температура ниже 38°, однако пациент не может прийти в лечебное учреждение по перечисленным выше причинам, он также имеет право вызвать врача на дом при ОРВИ.
Врач во время осмотра на дому или в поликлинике расспрашивает пациента о симптомах, о том, сколько держится температура, меряет давление, пальпирует живот и периферические лимфоузлы, осматривает кожные покровы, слизистые, простукивает и прослушивает грудную клетку, сердце, замеряет частоту дыхания.
Диагностика ОРВИ
Врачи диагностируют ОРВИ, опираясь на жалобы больного и визуальный осмотр. Дополнительно назначаются анализы мочи и крови. Обычно госпитализация не требуется. Если человек следует рекомендациям врача, в домашних условиях инфекция отступает довольно быстро. Поскольку заболеваемость ОРВИ носит чаще всего эпидемический характер, медики не пытаются выявлять конкретный возбудитель.
На этапе диагностики важно не перепутать ОРВИ с гриппом, поскольку симптоматика во многом похожа.
- Обычно ОРВИ развивается постепенно.
- Вначале возникает общая слабость, ощущение разбитости, практически сразу появляются насморк, боль в горле, осиплость, может возникнуть головная боль и повыситься температура.

- Грипп, в отличие от ОРВИ, всегда начинается весьма остро, с интенсивной головной боли, высокой температуры, рези в глазах, сильной ломоты в суставах и мышцах.
- Часто человек не может встать с кровати из-за слабости и головокружения.
- Только спустя несколько дней, когда боли проходят и температура снижается, появляется насморк или кашель (катаральные проявления).
В любом случае при наличии вышеописанных симптомов нельзя заниматься самодиагностикой. Необходимо обратиться к врачу.
Как лечить ОРВИ
При ОРВИ рекомендуется постельный режим. Следует пить много жидкости. Если температура поднимается выше 38,5°, необходимо принимать жаропонижающие. Остальные лекарства должен назначить врач.
При ОРВИ антибиотики не назначают. Против вирусов они не работают, а только перегружают печень. Применение таких лекарств целесообразно, если на фоне вирусной инфекции развивается бактериальная.
- Главная рекомендация врачей при ОРВИ – много пить, чтобы предупредить обезвоживание организма. Слизистые оболочки выполняют важную функцию – принимают на себя первый удар, задерживая вирусы. Если слизистая пересушена, она не может выполнять свою работу, и вирусы снова и снова попадают в организм. Слизь в носу, мокрота в бронхах – это тоже защитная реакция организма. Для образования этих субстанций также требуется влага, если ее не будет хватать, на быстрое оздоровление не стоит и рассчитывать. Влага теряется и с повышением температуры. При простуде советуют пить не меньше двух литров жидкости в сутки: теплые травяные чаи, морсы, компоты. Нельзя употреблять алкоголь, кофе и газировку, потому что они обладают обратным эффектом – выводят жидкость.
- Важно контролировать влажность в помещении.
 В квартирах с централизованным отоплением этот показатель порой снижается до 15–20 %, что приводит к пересыханию слизистой. С этой же целью рекомендуется промывать нос изотоническим (0,9%-м) солевым раствором, а также полоскать горло, поскольку соль обладает свойством удерживать влагу.
В квартирах с централизованным отоплением этот показатель порой снижается до 15–20 %, что приводит к пересыханию слизистой. С этой же целью рекомендуется промывать нос изотоническим (0,9%-м) солевым раствором, а также полоскать горло, поскольку соль обладает свойством удерживать влагу. - Если общее состояние плохое, сильно болит голова и горло, при ОРВИ можно принимать недорогие препараты на основе ибупрофена или парацетамола, обладающие также свойством понижать температуру.
- Рекомендуется почаще проветривать помещение, потому что вирусы активно размножаются в сухой и теплой среде. Лучше побыть дома несколько дней, дать возможность организму направить все силы на борьбу с вирусом. Простуда на ногах растянет время болезни, а это грозит осложнениями.
- Особо внимательно должны относиться к состоянию своего здоровья беременные. При первых же симптомах ОРВИ необходимо обратиться к врачу. Категорически запрещается заниматься самолечением. Ведь некоторые препараты, особенно в первом триместере беременности, опасны для малыша.

Врачи предупреждают об опасности приема даже самых эффективных противовирусных препаратов при ОРВИ без рекомендации терапевта. Это не всегда дает желаемый результат, а побочные эффекты вполне возможны.
Как вылечить ОРВИ домашними средствами
Существует много народных средств борьбы с простудой, многие из них являются весьма действенными. Однако самостоятельно сегодня они работают не всегда, поскольку вирусы очень быстро мутируют и приспосабливаются.
Врачи поддерживают бабушкины советы пить чай с малиной, молоко с медом и маслом. Теплое питье при простудах весьма желательно. Результативно борется с вирусами имбирь. Чай с имбирем, медом и лимоном – отличное согревающее средство в холодную пору года.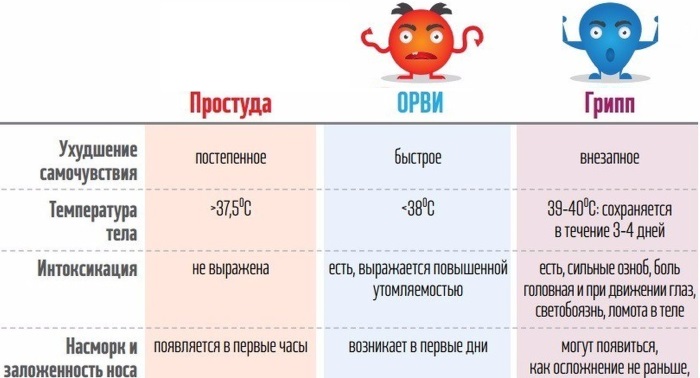 Он укрепляет иммунную систему, обладает потогонным и противовоспалительным свойством.
Он укрепляет иммунную систему, обладает потогонным и противовоспалительным свойством.
Мифы и опасные заблуждения в лечении ОРВИ
- Температуру в пределах 37–38,5° сбивать не нужно. Она свидетельствует, что включился естественный защитный механизм, начала работать иммунная система.
- Ингаляции рекомендованы, но сегодня для этого лучше использовать не кастрюлю с вареной картошкой, а безопасные современные ингаляторы, купленные в аптеке.
- Нет смысла использовать банки и горчичники, поскольку их эффективность никому так и не удалось доказать. Для прогревания (при отсутствии повышенной температуры!) лучше применять аптечные мази и сухое тепло.
- Нельзя закапывать неразбавленный сок лука и чеснока в нос, это вызовет ожог носоглотки.
 Хотя сами по себе эти растения очень полезны, поскольку содержат фитонциды.
Хотя сами по себе эти растения очень полезны, поскольку содержат фитонциды. - Бытует мнение, что после болезни вырабатывается иммунитет к простуде, однако ОРВИ – это группа респираторных заболеваний, возбудителями которых являются разные вирусы и их штаммы. Переболев один раз, вскоре можно заболеть повторно, если заражение произошло другим вирусом. К тому же эти агенты очень быстро меняются, поэтому иммунная система не успевает адаптироваться. Однако правильное полноценное питание, богатое витаминами и минералами, адекватные физические нагрузки, прогулки на свежем воздухе и позитивный настрой позволяют укрепить иммунитет и противостоять вирусной инфекции.
Профилактика
- В период эпидемий врачи рекомендуют детям и лицам с ослабленным иммунитетом ограничить посещение публичных мест.
 В школах для этого вполне разумно вводят карантин.
В школах для этого вполне разумно вводят карантин. - Взрослым, вынужденным ходить на работу, в магазины за покупками, ездить в общественном транспорте, рекомендуется чаще мыть руки с мылом, использовать дезинфицирующий спрей.
- Не помешает также промывать нос изотоническим раствором морской или обычной поваренной соли.
- К сезону простуд следует готовиться заранее. Медики рекомендуют придерживаться принципов здорового питания, употреблять достаточное количество овощей и фруктов, ограничить употребление алкоголя, не курить, спать не меньше 8 часов.
- Очень эффективным средством профилактики ОРВИ является закаливание. Оно способствует повышению адаптивных свойств организма. У закаленных людей наблюдается более быстрая реакция сосудов на холод, выше теплопродукция и диапазон температурной активности. У них улучшается кровообращение, нормализуется обмен веществ.
- Важно поддерживать оптимальную влажность воздуха в жилище постоянно, а не только во время болезни.
 В городских квартирах в отопительный период врачи рекомендуют использовать увлажнители, чтобы повысить ее как минимум до 60 %, особенно в детской комнате.
В городских квартирах в отопительный период врачи рекомендуют использовать увлажнители, чтобы повысить ее как минимум до 60 %, особенно в детской комнате.
Поскольку ОРВИ вызывают разные вирусы, универсальной вакцины от простуды пока не существует. Но против отдельных видов возбудителей эффективные препараты разрабатываются ежегодно. Осенью рекомендуется делать прививку против гриппа, медики всегда довольно точно прогнозируют, какой тип вируса будет преобладать в эпидемический сезон. Однако следует отметить: вакцинация не гарантирует, что вы не заболеете вообще, тем не менее болезнь будет протекать гораздо легче.
Острые респираторные инфекции у детей — приоритеты борьбы с заболеваниями в развивающихся странах
Острые респираторные инфекции (ОРИ) классифицируются как инфекции верхних дыхательных путей (URI) или инфекции нижних дыхательных путей (LRIs). Верхние дыхательные пути состоят из дыхательных путей от ноздрей до голосовых связок в гортани, включая придаточные пазухи носа и среднее ухо. Нижние дыхательные пути покрывают продолжение дыхательных путей от трахеи и бронхов к бронхиолам и альвеолам.ОРИ не ограничиваются дыхательными путями и имеют системные эффекты из-за возможного распространения инфекции или микробных токсинов, воспаления и снижения функции легких. Дифтерия, коклюш (коклюш) и корь — это болезни, которые можно предотвратить с помощью вакцин, которые могут иметь компонент дыхательных путей, но также влияют на другие системы; они обсуждаются в главе 20.
Нижние дыхательные пути покрывают продолжение дыхательных путей от трахеи и бронхов к бронхиолам и альвеолам.ОРИ не ограничиваются дыхательными путями и имеют системные эффекты из-за возможного распространения инфекции или микробных токсинов, воспаления и снижения функции легких. Дифтерия, коклюш (коклюш) и корь — это болезни, которые можно предотвратить с помощью вакцин, которые могут иметь компонент дыхательных путей, но также влияют на другие системы; они обсуждаются в главе 20.
За исключением периода новорожденности, ОРИ являются наиболее частой причиной как болезней, так и смертности детей в возрасте до пяти лет, у которых в среднем от трех до шести эпизодов ОРИ ежегодно, независимо от того, где они живут и в каком экономическом положении. есть (Камат и другие, 1969; Монто и Ульман, 1974).Тем не менее, соотношение легких и тяжелых заболеваний варьируется между странами с высоким и низким уровнем доходов, и из-за различий в конкретной этиологии и факторах риска тяжесть LRIs у детей в возрасте до пяти лет хуже в развивающихся странах, что приводит к более высокому уровню заболеваемости. летальность. Хотя медицинская помощь может до некоторой степени снизить как тяжесть заболевания, так и летальный исход, многие тяжелые формы LRI не поддаются лечению, в основном из-за отсутствия высокоэффективных противовирусных препаратов. Ежегодно умирает около 10,8 миллиона детей (Black, Morris, and Bryce, 2003).По оценкам, в 2000 году 1,9 миллиона из них умерли от ОРИ, 70 процентов из них — в Африке и Юго-Восточной Азии (Williams and others 2002). По оценкам Всемирной организации здравоохранения (ВОЗ), 2 миллиона детей в возрасте до пяти лет умирают от пневмонии ежегодно (Bryce and others 2005).
летальность. Хотя медицинская помощь может до некоторой степени снизить как тяжесть заболевания, так и летальный исход, многие тяжелые формы LRI не поддаются лечению, в основном из-за отсутствия высокоэффективных противовирусных препаратов. Ежегодно умирает около 10,8 миллиона детей (Black, Morris, and Bryce, 2003).По оценкам, в 2000 году 1,9 миллиона из них умерли от ОРИ, 70 процентов из них — в Африке и Юго-Восточной Азии (Williams and others 2002). По оценкам Всемирной организации здравоохранения (ВОЗ), 2 миллиона детей в возрасте до пяти лет умирают от пневмонии ежегодно (Bryce and others 2005).
Причины ОРИ и бремя болезней
ОРИ у детей уносят тяжелый урон жизни, особенно там, где медицинская помощь недоступна или за ней не обращаются.
Инфекции верхних дыхательных путей
URI являются наиболее распространенными инфекционными заболеваниями.К ним относятся ринит (простуда), синусит, инфекции уха, острый фарингит или тонзиллофарингит, эпиглоттит и ларингит, из которых инфекции уха и фарингит вызывают более серьезные осложнения (глухота и острая ревматическая лихорадка соответственно). Подавляющее большинство URI имеют вирусную этиологию. Риновирусы составляют от 25 до 30 процентов URI; респираторно-синцитиальные вирусы (РСВ), вирусы парагриппа и гриппа, метапневмовирус человека и аденовирусы — от 25 до 35 процентов; вирусы короны на 10 процентов; и неопознанные вирусы для остальных (Denny 1995).Поскольку большинство URI являются самоограничивающимися, их осложнения более важны, чем инфекции. Острые вирусные инфекции предрасполагают детей к бактериальным инфекциям носовых пазух и среднего уха (Berman 1995a), а аспирация инфицированных секретов и клеток может приводить к LRIs.
Подавляющее большинство URI имеют вирусную этиологию. Риновирусы составляют от 25 до 30 процентов URI; респираторно-синцитиальные вирусы (РСВ), вирусы парагриппа и гриппа, метапневмовирус человека и аденовирусы — от 25 до 35 процентов; вирусы короны на 10 процентов; и неопознанные вирусы для остальных (Denny 1995).Поскольку большинство URI являются самоограничивающимися, их осложнения более важны, чем инфекции. Острые вирусные инфекции предрасполагают детей к бактериальным инфекциям носовых пазух и среднего уха (Berman 1995a), а аспирация инфицированных секретов и клеток может приводить к LRIs.
Острый фарингит
Острый фарингит у детей младшего возраста более чем в 70% случаев вызывается вирусами. Типичны легкое покраснение глотки, отек и увеличение миндалин. Стрептококковая инфекция редко встречается у детей до пяти лет и более часто встречается у детей старшего возраста.В странах с многолюдными условиями жизни и группами населения, которые могут иметь генетическую предрасположенность, постстрептококковые последствия, такие как острый ревматизм и кардит, распространены у детей школьного возраста, но могут также возникать у детей младше пяти лет. Острый фарингит в сочетании с развитием перепонки в горле почти всегда вызывается в развивающихся странах Corynebacterium diphtheriae . Однако при почти повсеместной вакцинации младенцев вакциной АКДС (дифтерия-столбняк-коклюш) дифтерия встречается редко.
Острый фарингит в сочетании с развитием перепонки в горле почти всегда вызывается в развивающихся странах Corynebacterium diphtheriae . Однако при почти повсеместной вакцинации младенцев вакциной АКДС (дифтерия-столбняк-коклюш) дифтерия встречается редко.
Острая ушная инфекция
Острая ушная инфекция встречается у 30 процентов URI. В развивающихся странах с неадекватной медицинской помощью это может привести к перфорации барабанных перепонок и хроническим выделениям из уха в более позднем детстве и, в конечном итоге, к ухудшению слуха или глухоте (Berman 1995b). Хроническая ушная инфекция после повторных эпизодов острой ушной инфекции распространена в развивающихся странах, поражая от 2 до 6 процентов детей школьного возраста. Связанная с этим потеря слуха может приводить к инвалидности и влиять на обучение.Повторные ушные инфекции могут привести к мастоидиту, который, в свою очередь, может распространить инфекцию на мозговые оболочки. Мастоидит и другие осложнения, вызванные ОРВИ, являются причиной почти 5 процентов всех смертей от ОРИ во всем мире (Williams и др. , 2002).
, 2002).
Инфекции нижних дыхательных путей
Распространенными инфекциями нижних дыхательных путей у детей являются пневмония и бронхиолит. Частота дыхания является ценным клиническим признаком для диагностики острой ЛРН у кашляющих и учащенно дышащих детей. Наличие втягивания нижней грудной стенки указывает на более тяжелое заболевание (Mulholland и др., 1992; Shann, Hart, and Thomas 1984).
В настоящее время наиболее частыми причинами вирусных LRIs являются RSV. Они, как правило, очень сезонные, в отличие от вирусов парагриппа, следующей наиболее частой причины вирусных LRI. Эпидемиология вирусов гриппа у детей в развивающихся странах заслуживает срочного исследования, поскольку доступны безопасные и эффективные вакцины. До эффективного использования противокоревой вакцины вирус кори был самой важной вирусной причиной заболеваемости и смертности детей, связанных с респираторными путями, в развивающихся странах.
Пневмония
И бактерии, и вирусы могут вызывать пневмонию. Бактериальная пневмония часто вызывается Streptococcus pneumoniae (пневмококк) или Haemophilus influenzae, в основном типом b (Hib) и иногда Staphylococcus aureus или другими стрептококками. Всего от 8 до 12 из множества типов пневмококка вызывают большинство случаев бактериальной пневмонии, хотя конкретные типы могут различаться у взрослых и детей и в разных географических регионах.Другие патогены, такие как Mycoplasma pneumoniae и Chlamydia pneumoniae, , вызывают атипичные пневмонии. Их роль как причины тяжелых заболеваний у детей до пяти лет в развивающихся странах неясна.
Бактериальная пневмония часто вызывается Streptococcus pneumoniae (пневмококк) или Haemophilus influenzae, в основном типом b (Hib) и иногда Staphylococcus aureus или другими стрептококками. Всего от 8 до 12 из множества типов пневмококка вызывают большинство случаев бактериальной пневмонии, хотя конкретные типы могут различаться у взрослых и детей и в разных географических регионах.Другие патогены, такие как Mycoplasma pneumoniae и Chlamydia pneumoniae, , вызывают атипичные пневмонии. Их роль как причины тяжелых заболеваний у детей до пяти лет в развивающихся странах неясна.
Бремя LRIs, вызванного Hib или S. pneumoniae , трудно определить, поскольку современные методы установления бактериальной этиологии не обладают чувствительностью и специфичностью. Результаты посева из глотки не всегда позволяют выявить патоген, являющийся причиной LRI.Бактериальные культуры образцов аспирата легких часто считаются золотым стандартом, но они не подходят для применения в полевых условиях. Обзор нескольких исследований Вуори-Холопайнен и Пелтола (2001) показывает, что на S. pneumoniae и Hib приходится от 13 до 34 процентов и от 1,4 до 42,0 процентов бактериальных пневмоний, соответственно, тогда как исследования Адегбола и др. (1994), Шэнн, Граттен и другие (1984) и Уолл и другие (1986) предполагают, что Hib составляет от 5 до 11 процентов случаев пневмонии.
Обзор нескольких исследований Вуори-Холопайнен и Пелтола (2001) показывает, что на S. pneumoniae и Hib приходится от 13 до 34 процентов и от 1,4 до 42,0 процентов бактериальных пневмоний, соответственно, тогда как исследования Адегбола и др. (1994), Шэнн, Граттен и другие (1984) и Уолл и другие (1986) предполагают, что Hib составляет от 5 до 11 процентов случаев пневмонии.
Пониженные уровни клинической или радиологической пневмонии при клинических испытаниях девятивалентной пневмококковой конъюгированной вакцины дают оценку бремени болезней, предупреждаемых с помощью вакцины ( валентность указывает количество серотипов, от которых вакцина обеспечивает защиту; конъюгат относится к конъюгации полисахаридов с белковым остовом). В исследовании, проведенном в Гамбии, было предотвращено 37 процентов радиологической пневмонии, что отражает количество заболеваний, вызванных S.pneumoniae, , а смертность снизилась на 16 процентов (Cutts and others 2005).
Колонизация верхних дыхательных путей потенциально патогенными организмами и аспирация зараженных секретов участвуют в патогенезе бактериальной пневмонии у детей младшего возраста. Было показано, что инфицирование верхних дыхательных путей вирусом гриппа или RSV увеличивает связывание как H. influenzae (Jiang и др., 1999), так и S. pneumoniae (Hament and others 2004; McCullers and Bartmess 2003) с подкладкой. клетки носоглотки.Это открытие может объяснить, почему рост пневмококковой пневмонии идет параллельно с эпидемиями гриппа и RSV. Исследование, проведенное в Южной Африке, показало, что вакцинация девятивалентной пневмококковой конъюгированной вакциной снижает заболеваемость вирус-ассоциированной пневмонией, вызывающей госпитализацию, на 31 процент, что свидетельствует о том, что пневмококк играет важную роль в патогенезе вирус-ассоциированной пневмонии (Madhi, Petersen, Мадхи, Васас и др. 2000).
Попадание бактерий из кишечника с распространением через кровоток в легкие также было предложено для патогенеза грамотрицательных организмов (Fiddian-Green and Baker 1991), но такие бактерии являются необычными этиологическими агентами пневмонии у иммунокомпетентных дети. Однако у новорожденных и младенцев грудного возраста грамотрицательная пневмония не редкость (Quiambao готовится к печати).
Однако у новорожденных и младенцев грудного возраста грамотрицательная пневмония не редкость (Quiambao готовится к печати).
Вирусы ответственны за от 40 до 50 процентов инфекций у младенцев и детей, госпитализированных по поводу пневмонии в развивающихся странах (Hortal and others 1990; John and others 1991; Tupasi and others 1990). Вирус кори, RSV, вирусы парагриппа, вирус гриппа типа A и аденовирусы являются наиболее важными причинами вирусной пневмонии. Рентгенологически сложно отличить вирусную пневмонию от бактериальной, отчасти потому, что поражения выглядят одинаково, а отчасти потому, что бактериальная суперинфекция возникает при гриппе, кори и инфекциях RSV (Ghafoor и др., 1990).
В развивающихся странах уровень летальности среди детей с вирусной пневмонией колеблется от 1,0 до 7,3 процента (John and others 1991; Stensballe, Devasundaram, and Simoes 2003), с бактериальной пневмонией от 10 до 14 процентов и со смешанной вирусной и вирусной пневмонией. бактериальные инфекции от 16 до 18 процентов (Ghafoor и др. , 1990; Shann, 1986).
, 1990; Shann, 1986).
Бронхиолит
Бронхиолит возникает преимущественно в первый год жизни и с уменьшающейся частотой во второй и третий годы.Клинические признаки включают учащенное дыхание и втягивание нижней грудной стенки, лихорадку в одной трети случаев и хрипы (Cherian и др., 1990). Воспалительная обструкция мелких дыхательных путей, которая приводит к гиперинфляции легких и коллапсу сегментов легкого. Поскольку признаки и симптомы также характерны для пневмонии, работникам здравоохранения может быть сложно провести различие между бронхиолитом и пневмонией. Две особенности, которые могут помочь, — это определение сезонности RSV в данной местности и умение обнаруживать хрипы.RSV являются основной причиной бронхиолита во всем мире и могут вызывать до 70 или 80 процентов LRI в высокий сезон (Simoes 1999; Stensballe, Devasundaram и Simoes 2003). Недавно обнаруженный метапневмовирус человека также вызывает бронхиолит (Van den Hoogen и др., 2001), который неотличим от болезни RSV. Другие вирусы, вызывающие бронхиолит, включают вирус парагриппа 3-го типа и вирусы гриппа.
Другие вирусы, вызывающие бронхиолит, включают вирус парагриппа 3-го типа и вирусы гриппа.
Грипп
Несмотря на то, что вирусы гриппа обычно вызывают инфекционные заболевания дыхательных путей у взрослых, они все чаще рассматриваются как важная причина инфекционных заболеваний кишечника у детей и, возможно, вторая по значимости причина госпитализации детей с ОРВ после RSV (Neuzil and others 2002). .Хотя грипп считается нечастым в развивающихся странах, его эпидемиология еще требует тщательного изучения. Потенциальное бремя гриппа как причина смерти детей неизвестно. Вирус гриппа типа A может вызывать сезонные вспышки, а тип B может вызывать спорадические инфекции. В последнее время вирус птичьего гриппа стал причиной инфекции, болезней и смерти небольшого числа людей, включая детей, в нескольких азиатских странах. Его потенциал для возникновения вспышек среди людей или пандемии неизвестен, но он может иметь разрушительные последствия для развивающихся стран (Peiris and others 2004) и может представлять угрозу для здоровья во всем мире. Новые штаммы вирусов типа А почти наверняка возникнут в результате мутации, как это произошло в случае пандемий в Азии и Гонконге в 1950-х и 1960-х годах.
Новые штаммы вирусов типа А почти наверняка возникнут в результате мутации, как это произошло в случае пандемий в Азии и Гонконге в 1950-х и 1960-х годах.
ВИЧ-инфекция и педиатрические LRIs
Во всем мире 3,2 миллиона детей живут с ВИЧ / СПИДом, 85 процентов из них — в странах Африки к югу от Сахары (ЮНЭЙДС, 2002). В южной части Африки инфекционные заболевания, связанные с ВИЧ, составляют от 30 до 40 процентов случаев госпитализации детей и имеют показатель летальности от 15 до 34 процентов, что намного выше, чем 5-10 процентов для детей, не инфицированных ВИЧ (Bobat and others 1999; Мадхи, Петерсен, Мадхи, Хосал и другие, 2000; Натху и другие, 1993; Цви, Петтифиор и Содерлунд, 1999). Pneumocystis jiroveci и цитомегаловирус являются важными условно-патогенными инфекциями более чем у 50 процентов ВИЧ-инфицированных младенцев (Jeena, Coovadia, and Chrystal 1996; Lucas and others 1996). Грамотрицательные бактерии также важны для более чем 70 процентов ВИЧ-инфицированных детей с недостаточным питанием (Ikeogu, Wolf, and Mathe, 1997). Исследования пациентов подтвердили частую ассоциацию этих бактерий, но добавили S. pneumoniae и S. aureus в качестве важных патогенов (Gilks 1993; Goel and others 1999).В первом южноафриканском отчете об общем бремени инвазивной пневмококковой инфекции сообщается о 41,7-кратном увеличении числа ВИЧ-инфицированных детей по сравнению с неинфицированными детьми (Фарли и др., 1994).
Исследования пациентов подтвердили частую ассоциацию этих бактерий, но добавили S. pneumoniae и S. aureus в качестве важных патогенов (Gilks 1993; Goel and others 1999).В первом южноафриканском отчете об общем бремени инвазивной пневмококковой инфекции сообщается о 41,7-кратном увеличении числа ВИЧ-инфицированных детей по сравнению с неинфицированными детьми (Фарли и др., 1994).
Вмешательства
Вмешательства по борьбе с ОРИ можно разделить на четыре основные категории: иммунизация против конкретных патогенов, ранняя диагностика и лечение заболеваний, улучшение питания и более безопасная среда (John 1994). Первые два относятся к сфере компетенции системы здравоохранения, тогда как последние два относятся к сфере общественного здравоохранения и требуют многосекторального участия.
Прививки
Широкое использование вакцин против кори, дифтерии, коклюша, Hib, пневмококка и гриппа может существенно снизить заболеваемость ОРИ у детей в развивающихся странах. Влияние вакцин против кори, дифтерии и коклюша обсуждается в главе 20. Ограниченные данные о гриппе в развивающихся странах не позволяют провести подробный анализ потенциальных преимуществ этой вакцины. Поэтому в этой главе основное внимание уделяется потенциальному воздействию вакцин против Hib и пневмококка на LRI.
Вакцина против Hib
В настоящее время доступны три конъюгированные вакцины против Hib для применения у младенцев и детей младшего возраста. Эффективность вакцины против Hib в предотвращении инвазивных заболеваний (в основном менингита, но также и пневмонии) была хорошо задокументирована в нескольких исследованиях, проведенных в промышленно развитых странах (Black and others 1992; Booy and others 1994; Eskola and others 1990; Fritzell and Plotkin 1992; Heath 1998; Lagos and others 1996; Santosham and others 1991) и в одном исследовании в Гамбии (Mulholland and others 1997).Все исследования показали защитную эффективность более 90% против лабораторно подтвержденных инвазивных заболеваний, независимо от выбора вакцины. Следовательно, все промышленно развитые страны включают вакцину против Hib в свои национальные программы иммунизации, что приводит к фактической ликвидации инвазивной болезни Hib из-за иммунитета у вакцинированных и эффекта стада у тех, кто не вакцинирован. Имеющиеся данные из нескольких развивающихся стран показывают аналогичный эффект стада (Адегбола и др., 1999; Венгер и др., 1999).
Первоначальное обещание и последующее общее мнение заключалось в том, что вакцина против Hib предназначена для защиты от менингита, но в развивающихся странах вакцина, вероятно, будет иметь больший эффект в предотвращении LRI. Эффект легко измерить при инвазивных заболеваниях, включая бактериемическую пневмонию. Вакцина, вероятно, оказывает влияние на небактериемическую пневмонию, но этот эффект трудно определить количественно из-за отсутствия адекватного метода установления бактериальной этиологии. В Бангладеш, Бразилии, Чили и Гамбии вакцина против Hib была связана с уменьшением на 20-30 процентов числа госпитализированных с рентгенологически подтвержденной пневмонией (de Andrade and others 2004; Levine and others 1999; Mulholland and others 1997; WHO 2004a ).Однако результаты большого исследования в Ломбоке, Индонезия, не дали окончательных результатов в отношении влияния вакцины против Hib на пневмонию (Gessner and others 2005).
Пневмококковые вакцины
В настоящее время доступны два вида вакцин против пневмококков: 23-валентная полисахаридная вакцина (23-PSV), которая больше подходит для взрослых, чем для детей, и 7-валентная полисахаридная вакцина, конъюгированная с белком (7- PCV). 9-валентная вакцина (9-PCV) прошла клинические испытания в Гамбии и Южной Африке, а 11-валентная вакцина (11-PCV) проходит испытания на Филиппинах.
Исследования эффективности полисахаридной вакцины в профилактике ОРИ или ушных инфекций у детей в промышленно развитых странах показали противоречивые результаты. В то время как некоторые исследования этой вакцины не показывают значительной эффективности (Douglas and Miles 1984; Sloyer, Ploussard and Howie 1981), исследования из Финляндии показывают в целом защитный эффект против серотипов, содержащихся в 14-PSV (Douglas and Miles 1984; Karma and другие 1980; Макела и другие 1980). Эффективность была более выражена у детей старше двух лет, чем у детей младшего возраста.Единственные исследования, оценивающие действие полисахаридной вакцины на детей в развивающихся странах, — это серия из трех испытаний, проведенных в Папуа-Новой Гвинее (Douglas and Miles 1984; Lehmann and others 1991; Riley and others 1981; Riley, Lehmann, and Alpers 1991). . Анализ объединенных данных этих испытаний показал снижение смертности от LRI на 59 процентов среди детей до пяти лет на момент вакцинации и на 50 процентов среди детей до двух лет. На основании этих и других исследований исследователи пришли к выводу, что вакцина оказывает влияние на тяжелую пневмонию.Более высокая, чем ожидалось, эффективность в этих испытаниях была приписана большему вкладу более иммуногенных серотипов взрослых в пневмонию в Папуа-Новой Гвинее (Douglas and Miles 1984; Riley, Lehmann, and Alpers 1991). Из-за низкой иммуногенности антигенов в 23-PSV против преобладающих детских серотипов внимание теперь направлено на более иммуногенные конъюгированные вакцины (Mulholland 1998; Obaro 1998; Temple 1991).
Эффективность 7-PCV и 9-PCV была оценена на предмет эффективности против инвазивного пневмококкового заболевания в четырех испытаниях, которые продемонстрировали эффективность вакцины от 71.От 0 до 97,4 процента (от 58 до 65 процентов для ВИЧ-положительных детей, среди которых заболеваемость пневмококком в 40 раз выше, чем среди ВИЧ-отрицательных детей) (Black and others 2000; Cutts and others 2005; Klugman and others 2003; O ‘ Брайен и другие 2003).
В США 7-PCV был включен в плановую вакцинацию младенцев и детей в возрасте до двух лет в 2000 году. К 2001 году заболеваемость всеми инвазивными пневмококковыми заболеваниями в этой возрастной группе снизилась на 69 процентов, а заболевания, вызываемые включенными серотипами вакцины и родственных серотипов снизились на 78 процентов (Whitney and others 2003).Подобные сокращения были подтверждены в исследовании в северной Калифорнии (Black and others 2001). Наблюдалось небольшое увеличение частоты инвазивных заболеваний, вызванных серотипами пневмококков, не включенных в вакцину, но оно было недостаточно большим, чтобы компенсировать существенное снижение заболеваемости, вызванное вакциной. Исследования также обнаружили значительное снижение инвазивной пневмококковой инфекции в непривитых старших возрастных группах, особенно среди взрослых в возрасте от 20 до 39 лет и в возрасте 65 лет и старше, что позволяет предположить, что вакцинация маленьких детей оказала значительный эффект в обществе.Такое преимущество может иметь место даже там, где распространенность ВИЧ-инфекции среди взрослых высока, а пневмококковая инфекция может быть рецидивирующей и опасной для жизни.
Воздействие вакцины на пневмококковую пневмонию как таковое трудно определить из-за проблем, связанных с установлением бактериальной этиологии пневмонии. В трех исследованиях оценивали влияние вакцины на рентгенологическую пневмонию (независимо от этиологического агента) и показали снижение на 20,5-37,0% случаев пневмонии, подтвержденной рентгенологически (9.0 процентов для ВИЧ-инфицированных) (Black and others 2000; Cutts and others 2005; Klugman and others 2003).
Несколько полевых испытаний оценили эффективность PCV против ушной инфекции. Несмотря на то, что вакцина привела к значительному сокращению подтвержденного посевом пневмококка отита, чистого снижения ушной инфекции среди вакцинированных детей не наблюдалось, вероятно, из-за увеличения частоты отита, вызванного видами пневмококков, не охваченных вакциной, ЧАС.influenzae и Moraxella catarrhalis (Eskola and others 2001; Kilpi and others 2003). Однако испытание в северной Калифорнии показало, что вакцина обладает защитным действием против частых инфекций уха и снижает потребность в установке тимпаностомической трубки (Fireman and others 2003). Таким образом, вакцина от ушной инфекции может быть полезной в развивающихся странах с высокими показателями хронического отита и кондуктивной тугоухости, и ее следует оценивать с помощью клинических испытаний.
Самым заметным преимуществом вакцины для общественного здравоохранения в развивающихся странах будет очевидное снижение смертности.Хотя первичным результатом исследования в Гамбии изначально была детская смертность, она была изменена на радиологическую пневмонию. Тем не менее, испытание показало снижение смертности на 16 процентов (уровень достоверности 95 процентов, от 3 до 38). Это испытание проводилось в сельской местности на востоке Гамбии, где трудно обеспечить круглосуточную лечебную помощь, включая ведение больных. Это испытание демонстрирует, что иммунизация, проводимая в рамках аутрич-программ, принесет значительную пользу для здоровья и экономики таких групп населения.Еще одно исследование, оценивающее влияние 11-PCV на радиологическую пневмонию, продолжается на Филиппинах; результаты ожидаются во второй половине 2005 года.
Ведение пациентов
Упрощение и систематизация ведения пациентов для ранней диагностики и лечения ОРИ позволили значительно снизить смертность в развивающихся странах, где доступ к педиатрам ограничен. В клинических рекомендациях ВОЗ по ведению случаев ОРИ (ВОЗ, 1991) используются два ключевых клинических признака: частота дыхания, , чтобы отличить детей с пневмонией от детей без, и втягивание нижней грудной стенки, , чтобы определить тяжелую пневмонию, требующую направления и госпитализации.Детям со слышимым стридором в спокойном и спокойном состоянии или такими опасными признаками тяжелого заболевания, как неспособность есть, также требуется направление. Дети без этих признаков классифицируются как страдающие ОРИ, но не пневмонией. Детей, у которых наблюдается только учащенное дыхание, лечат пневмонию амбулаторно. Детей, которые кашляют более 30 дней, направляют для дальнейшего обследования на туберкулез и другие хронические инфекции.
Диагностика пневмонии на основе учащенного дыхания
Первоначальные рекомендации по выявлению пневмонии на основе учащенного дыхания были разработаны в Папуа-Новой Гвинее в 1970-х годах.В исследовании 200 последовательных педиатрических пациентов и 50 последовательных госпитализаций (Shann, Hart, and Thomas 1984) 72 процента детей со слышимым хрипом в легких имели частоту дыхания 50 или более вдохов в минуту, тогда как только 19 процентов детей без потрескивания дышал с такой стремительной скоростью. Поэтому в первоначальных рекомендациях ВОЗ использовался порог в 50 вдохов в минуту, при достижении которого кашель у ребенка считался пневмонией.
Основное беспокойство вызывает относительно низкая чувствительность этого подхода, который может упустить от 25 до 40 процентов случаев пневмонии.Исследование в Веллоре, Индия, показало, что чувствительность можно улучшить, снизив порог до 40 для детей в возрасте от 1 до 4 лет, сохранив порог в 50 вдохов в минуту для младенцев в возрасте от 2 до 11 месяцев (Cherian and others 1988). Последующие исследования показали, что при использовании этих пороговых значений чувствительность улучшилась с 62 до 79 процентов на Филиппинах и с 65 до 77 процентов в Свазиленде, но в то же время специфичность упала с 92 до 77 процентов на Филиппинах и с 92 до 80 процентов. процентов в Свазиленде (Mulholland и др., 1992).На основе этих и других данных (Кэмпбелл, Байасс и др., 1989; Колстад и др., 1997; Перкинс и др., 1997; Редд, 1994; Симоес и др., 1997; Вебер и др., 1997) ВОЗ рекомендует ограничить частоту дыхания на 50 вдохов. в минуту для детей в возрасте от 2 до 11 месяцев и 40 вдохов в минуту для детей в возрасте от 12 месяцев до 5 лет.
Учащенное дыхание, по определению ВОЗ, выявляет около 85 процентов детей с пневмонией, и более 80 процентов детей с потенциально смертельной пневмонией, вероятно, успешно выявляются и лечатся с использованием диагностических критериев ВОЗ.Было показано, что лечение детей с учащенным дыханием антибиотиками снижает смертность (Sazawal and Black 2003). Проблема низкой специфичности критерия учащенного дыхания заключается в том, что от 70 до 80 процентов детей, которые могут не нуждаться в антибиотиках, получат их. Тем не менее, для работников первичной медико-санитарной помощи, для которых важна простота диагностики, учащенное дыхание, несомненно, является наиболее полезным клиническим признаком.
Диагноз пневмонии на основании втягивания грудной стенки
Дети поступают в больницу с тяжелой пневмонией, когда медицинские работники считают, что необходимы кислородные или парентеральные антибиотики (антибиотики, вводимые не перорально), или когда они не уверены в способности матери справиться .Обоснование парентеральных антибиотиков состоит в том, чтобы достичь более высоких уровней антибиотиков и преодолеть опасения по поводу абсорбции пероральных препаратов у больных детей.
В исследовании Папуа-Новой Гвинеи (Shann, Hart, and Thomas 1984) втягивание грудной клетки использовалось в качестве основного показателя тяжести, но исследования, проведенные в разных частях мира, показывают большие различия в темпах втягивания из-за различных определений. Ограничение этого термина втягиванием нижней грудной стенки, определяемым как движение внутрь костных структур грудной стенки с вдохом, предоставило лучший индикатор тяжести пневмонии, который можно научить медработникам.Он более специфичен, чем втяжение межреберных промежутков, которое часто встречается при бронхиолите.
В исследовании, проведенном в Гамбии (Кэмпбелл, Байасс и др., 1989), когорта из 500 детей от рождения до четырех лет посещалась дома еженедельно в течение одного года. За это время в клинику было направлено 222 эпизода LRI (учащенное дыхание, любое втягивание грудной стенки, расширение носа, свистящее дыхание, стридор или признаки опасности). Втяжение грудной клетки имело место в 62 процентах этих случаев, во многих случаях втягивание межреберных мышц.Если бы всех детей с каким-либо втягиванием грудной клетки госпитализировали, их количество превысило бы количество детских стационаров.
Исследования, проведенные на Филиппинах и в Свазиленде (Mulholland и др., 1992), показали, что втягивание нижней грудной стенки было более специфичным, чем втягивание межреберья, для диагностики тяжелой пневмонии, требующей госпитализации. В исследовании Веллора (Cherian and others 1988) втягивание нижней грудной стенки правильно предсказало 79 процентов детей с LRI, которые были госпитализированы педиатром.
Варианты противомикробных препаратов для перорального лечения пневмонии
Выбор противомикробного препарата для лечения основан на хорошо известных данных о том, что большинство бактериальных пневмоний у детей вызывается S. pneumoniae или H. influenzae . Однократная инъекция бензатин-пенициллина, хотя и длится долго, не обеспечивает адекватных уровней пенициллина для уничтожения H. influenzae . У ВОЗ есть технические документы, помогающие оценить соответствующие факторы при выборе противомикробных препаратов первого и второго ряда и сравнения различных противомикробных препаратов в отношении их антибактериальной активности, эффективности лечения и токсичности (ВОЗ, 1990).
Возникновение устойчивости к противомикробным препаратам у S. pneumoniae и H. influenzae вызывает серьезную озабоченность. В некоторых условиях тесты in vitro показывают, что более 50 процентов респираторных изолятов обеих бактерий устойчивы к ко-тримоксазолу, а устойчивость к пенициллину к S. pneumoniae постепенно становится проблемой во всем мире.
При пневмонии, в отличие от менингита, устойчивость возбудителя in vitro не всегда приводит к неэффективности лечения.Сообщения из Испании и Южной Африки предполагают, что пневмонию, вызванную устойчивым к пенициллину S. pneumoniae , можно успешно лечить с помощью достаточно высоких доз пенициллина. Амоксициллин концентрируется в тканях и макрофагах, и уровни препарата напрямую зависят от пероральных дозировок. Поэтому для успешного лечения ушных инфекций, вызванных устойчивым к пенициллину S. pneumoniae , в настоящее время используются более высокие дозы, чем в прошлом, — назначаемые дважды в день. Амоксициллин явно лучше пенициллина при таких инфекциях.Ситуация с ко-тримоксазолом менее ясна (Strauss and others 1998), и перед лицом высоких показателей устойчивости к ко-тримоксазолу амоксициллин может быть лучше для детей с тяжелой пневмонией.
Внутримышечные антибиотики для лечения тяжелой пневмонии
Несмотря на то, что хлорамфеникол активен против S. pneumoniae и H. influenzae, его пероральное всасывание у чрезвычайно больных детей нестабильно. Таким образом, рекомендации ВОЗ рекомендуют вводить хлорамфеникол внутримышечно в половине суточной дозы до срочного направления пациентов с тяжелой пневмонией.Дополнительным объяснением является то, что у крайне больных детей может быть сепсис или менингит, которые трудно исключить, и их необходимо немедленно лечить. Хотя внутривенный хлорамфеникол превосходит внутримышечный хлорамфеникол, процедура может отсрочить срочно необходимое лечение и увеличивает его стоимость.
Исследователи поставили под сомнение адекватность и безопасность внутримышечного хлорамфеникола. Хотя ранние исследования показали, что уровни взрослого в крови после внутримышечного введения были значительно ниже, чем после внутривенного введения, внутримышечный путь введения получил широкое признание после клинических отчетов, которые подтвердили его эффективность.Местные осложнения при внутримышечном введении сукцината левомицетина возникают редко, в отличие от более ранних внутримышечных препаратов. Хотя беспокойство по поводу апластической анемии после приема хлорамфеникола является обычным явлением, это осложнение крайне редко встречается у маленьких детей. Нет никаких доказательств того, что сукцинат хлорамфеникола внутримышечно вызывает побочные эффекты с большей вероятностью, чем другие формы и пути введения хлорамфеникола.
Диагностика гипоксемии на основе критериев ВОЗ
Стратегии ведения случаев ОРИ и комплексного ведения болезней грудного и детского возраста (ИВБДВ) зависят от точного направления больных детей в больницу и правильного стационарного лечения ИРН с применением кислорода или антибиотиков.Гипоксемия (дефицит кислорода в крови) у детей с LRI является хорошим предиктором смертности, коэффициент летальности в 1,2-4,6 раза выше при гипоксемическом LRI, чем при негипоксемическом LRI (Duke, Mgone, and Frank 2001; Onyango and others 1993). ), а кислород снижает смертность. Таким образом, важно как можно раньше выявлять гипоксемию у детей с LRI, чтобы предотвратить смерть. Хотя диагноз острой LRIs очень легко устанавливается путем распознавания тахипноэ, и хотя тяжелая LRI связана с втягиванием грудной стенки, клиническое распознавание гипоксемии более проблематично.Были изучены различные наборы клинических правил для прогнозирования наличия гипоксемии у детей с LRI (Cherian и др., 1988; Onyango и др., 1993; Usen и др., 1999). Хотя некоторые клинические инструменты обладают высокой чувствительностью для выявления гипоксемии, большое количество детей с гипоксемией все же будет пропущено при использовании этих критериев. Пульсоксиметрия — лучший инструмент для быстрого выявления гипоксемии у больных детей. Однако пульсоксиметры дороги и требуют периодических затрат на замену датчиков, по которым они недоступны в большинстве районных или даже специализированных больниц в развивающихся странах.
Руководство по лечению
Текущие рекомендации включают прием ко-тримоксазола два раза в день в течение пяти дней при пневмонии и внутримышечный пенициллин или хлорамфеникол для детей с тяжелой пневмонией. Проблемы повышения устойчивости к ко-тримоксазолу и ненужные направления детей с втягиванием грудной стенки привели к исследованиям, в которых изучаются альтернативы антибиотикам, которые в настоящее время используются при лечении ОРИ. Одно исследование показало, что амоксициллин и котримоксазол одинаково эффективны при нетяжелой пневмонии (Catchup Study Group 2002), хотя амоксициллин стоит в два раза дороже, чем котримоксазол.Что касается продолжительности лечения антибиотиками, исследования в Бангладеш, Индии и Индонезии показывают, что трехдневный пероральный прием котримоксазола или амоксициллина так же эффективен, как пять дней приема любого из препаратов у детей с нетяжелой пневмонией (Agarwal and others 2004; Kartasasmita 2003). ). В многоцентровом исследовании пенициллина, вводимого внутримышечно, и перорального амоксициллина у детей с тяжелой пневмонией, Аддо-Йобо и другие (2004) обнаружили схожие показатели излечения. Поскольку пациенты получали кислород при необходимости от гипоксемии и были переведены на другие антибиотики в случае неудачи, этот режим не подходит для лечения тяжелой пневмонии в амбулаторных условиях.
ВОЗ рекомендует назначать кислород, если он имеется в достаточном количестве, детям с признаками и симптомами тяжелой пневмонии и, если подача ограничена, детям с любым из следующих признаков: неспособность есть и пить, цианоз, частота дыхания выше или равный 70 вдохам в минуту, или серьезное втягивание грудной стенки (ВОЗ, 1993). Кислород следует вводить со скоростью 0,5 литра в минуту для детей младше 2 месяцев и 1 литр в минуту для детей старшего возраста. Поскольку кислород стоит дорого и его не хватает, особенно в отдаленных сельских районах развивающихся стран, ВОЗ рекомендует простые клинические признаки для выявления и лечения гипоксемии.Несмотря на эти рекомендации, исследование 21 учреждения первого уровня и районной больницы в семи развивающихся странах показало, что более 50 процентов госпитализированных детей с LRI неправильно лечились антибиотиками или кислородом (Nolan and others 2001), а в некоторых случаях кислород был недостаточным. в дефиците. Очевидно, что обеспечение кислородом младенцев с гипоксемией спасает жизнь, хотя никаких рандомизированных испытаний, подтверждающих это, не проводилось.
Профилактика и лечение пневмонии у ВИЧ-позитивных детей
Текущие рекомендации группы ВОЗ по ведению пневмонии у ВИЧ-позитивных детей и профилактике Pneumocystis jiroveci следующие (ВОЗ 2003):
Нетяжелая пневмония в возрасте до 5 лет. Пероральный котримоксазол должен оставаться антибиотиком первой линии, но следует использовать пероральный амоксициллин, если он доступен по цене или если ребенок проходил профилактику котримоксазолом.
Тяжелая или очень тяжелая пневмония. Нормальные руководящие принципы ВОЗ по ведению больных следует использовать для детей в возрасте до 2 месяцев. Детям от 2 до 11 месяцев рекомендуются инъекционные антибиотики и лечение пневмонии Pneumocystis jiroveci , а также начинается профилактика пневмонии Pneumocystis jiroveci после выздоровления.Для детей в возрасте от 12 до 59 месяцев лечение состоит из инъекционных антибиотиков и терапии пневмонии Pneumocystis jiroveci . Pneumocystis jiroveci Профилактика пневмонии должна проводиться в течение 15 месяцев детям, рожденным от ВИЧ-инфицированных матерей; однако эта рекомендация редко выполнялась.
Рентабельность вмешательств
Пневмония является причиной примерно пятой части из примерно 10,6 миллиона случаев смерти детей в возрасте до пяти лет в год.Там, где первичная медико-санитарная помощь является слабой, сокращение смертности с помощью мер общественного здравоохранения является приоритетной задачей. Как отмечалось ранее, доступные вмешательства — это первичная профилактика путем вакцинации и вторичная профилактика путем раннего выявления и ведения случаев заболевания.
Рентабельность вакцин против Hib обсуждается в главе 20. Мы не пытались анализировать рентабельность пневмококковых вакцин, потому что глобальные и региональные оценки бремени пневмококковой пневмонии в настоящее время разрабатываются и будут доступны только после позже в 2005 году.Кроме того, текущие цены на вакцины относительно стабильны в развитых странах, но ожидается, что цены для стран с низким и средним уровнем доходов будут значительно ниже, если вакцины закупаются на глобальном тендере.
Мы оцениваем стратегии вмешательства по ведению случаев LRIs у детей в возрасте до пяти лет. Медицинские работники, которые внедряют ведение пациентов, диагностируют LRI на основании учащенного дыхания, втягивания нижней грудной стенки или отдельных признаков опасности у детей с респираторными симптомами.Поскольку этот метод не делает различий между пневмонией и бронхиолитом, а также между бактериальной и вирусной пневмонией, мы группируем эти состояния в общую категорию «клиническая пневмония» (Rudan and others 2004). Этот подход предполагает, что большая часть клинической пневмонии имеет бактериальное происхождение и что медицинские работники могут значительно снизить летальность посредством диагностики частоты дыхания и своевременного приема антибиотиков (Sazawal and Black 2003). Мы рассчитали затраты на лечение по регионам Всемирного банка, используя стандартизованные исходные затраты, предоставленные редакторами томов, и затраты, опубликованные в Международном справочнике по индикаторам цен на лекарства (Management Sciences for Health 2005) и другой литературе ().В анализе рассматриваются четыре категории ведения больных, которые различаются тяжестью инфекции и точкой лечения:
Таблица 25.1
Входные данные для ведения случаев пневмонии в странах с низким и средним уровнем доходов.
нетяжелая пневмония, лечение в больнице
нетяжелая пневмония, лечение в медицинском учреждении
тяжелая пневмония, лечение в больнице
очень тяжелая пневмония, лечение в больнице.
Информация об этих категориях ведения пациентов и их результатах взята из отчета о методологии и предположениях, использованных для оценки затрат на расширение масштабов отдельных медицинских вмешательств, направленных на детей (ВОЗ и Здоровье детей-подростков, готовится к печати). Мы предположили, что для каждого пациента, которого лечит местный медицинский работник, в общей сложности будет три контрольных визита, а не повторные осмотры два раза в день в течение 10 дней, рекомендованные в отчете. Мы также предположили, что все пациенты с тяжелой пневмонией проходят рентгенологическое обследование, а не только 20 процентов, как это предлагается в отчете.Более того, мы приняли пятичасовой рабочий день для общинного медработника, минимальный рабочий день, необходимый для общинных медицинских работников в рамках инициативы «Здоровье и выживание детей» Агентства США по международному развитию (Bhattacharyya and others 2001).
представляет региональные оценки средних затрат на лечение на эпизод для четырех стратегий ведения случая. Поскольку мы считали, что цены на торгуемые товары, такие как лекарства и кислород, постоянны в разных регионах, региональные различия были вызваны различиями в расходах на больницы и медицинских работников.Латинская Америка и Карибский бассейн, Ближний Восток и Северная Африка имели самые высокие затраты на лечение.
Таблица 25.2
Средние затраты на лечение за один эпизод вмешательств по ведению пациентов с острой респираторной инфекцией нижних дыхательных путей (2001 долл. США).
Мы рассчитали региональные коэффициенты экономической эффективности (ССВ) для модельной численности населения в 1 миллион человек в каждом регионе, следуя стандартизированным руководящим принципам для экономического анализа (подробности см. В главе 15). Входные переменные включали стоимость лечения, подробно описанную в и, региональные показатели заболеваемости LRI, адаптированные из материалов Рудана и других (готовится к публикации), региональные показатели смертности и возрастные структуры, предоставленные редакторами томов, а также соотношение городского и сельского населения по регионам (World Банк 2002).Регион Европы и Центральной Азии был исключен из этого анализа из-за отсутствия информации о заболеваемости. В связи с отсутствием информации по регионам, мы предположили, что уровни эффективности вмешательства будут одинаковыми.
Количество лет жизни с поправкой на инвалидность можно предотвратить за счет сокращения продолжительности болезни и снижения смертности с помощью лечения. Мы предположили, что средняя продолжительность болезни составляет 8,5 дней для тех, кто не лечился, и 6,0 дней для тех, кто лечился. Мы использовали снижение летальности на 36,0% за счет лечения (Sazawal and Black 2003) и специфичность диагноза 78.5 процентов для пациентов, которым поставлен диагноз только на основании частоты дыхания. Вес нетрудоспособности одновременно с инфекцией составил 0,28. Мы не рассматривали инвалидность, вызванную хроническими последствиями LRI, потому что неясно, вызывает ли LRI в детстве долгосрочное нарушение функции легких или дети, у которых развивается нарушение функции легких, более склонны к инфекции (von Mutius 2001).
Поскольку один год этих вмешательств дает только одновременные выгоды — поскольку эффективно пролеченные люди не обязательно доживают до ожидаемой продолжительности жизни, учитывая, что они, вероятно, снова заразятся в следующем году, — мы рассчитали рентабельность пятилетнего вмешательства .Этот период времени позволил нам рассмотреть случай, когда целая когорта новорожденных и детей в возрасте от четырех лет избежала смертности от клинической пневмонии в раннем детстве благодаря вмешательству и получила преимущество, дожившее до ожидаемой продолжительности жизни. Наконец, в этом анализе учитывались только долгосрочные предельные затраты, которые варьируются в зависимости от количества пациентов, прошедших лечение, и не учитывались постоянные затраты на запуск программы, которых в настоящее время не существует.
представляет ССВ для конкретных регионов четырех категорий ведения случаев, а также ССВ для предоставления всех четырех категорий населению в 1 миллион человек.Во всех странах с низким и средним уровнем доходов лечение нетяжелой клинической пневмонии было более рентабельным на уровне учреждения, чем на уровне общины, и из всех четырех категорий ведения случая лечение очень тяжелой клинической пневмонии на уровне больниц было более эффективным. наименее рентабельный. Лечение нетяжелой клинической пневмонии на уровне учреждения было более рентабельным, чем лечение общинным работником здравоохранения, из-за более низкой стоимости одного посещения медицинского учреждения, чем многократных посещений медицинского работника.CER предоставления всех уровней лечения для всех стран с низким и средним уровнем доходов оценивается в 398 долларов США на год жизни с поправкой на инвалидность.
Таблица 25.3
ССВ вмешательств по ведению пациентов с пневмонией (2001 долл. США / год жизни с поправкой на инвалидность).
Поскольку мы предположили, что показатели эффективности были постоянными, региональные различия в CER для каждой категории ведения случая были связаны только с вариациями затрат на вмешательство, а относительные рейтинги экономической эффективности для стратегий были одинаковыми для всех регионов.Различия в ССВ для оказания всех категорий медицинской помощи также были обусловлены региональным соотношением городского и сельского населения. Мы предположили, что все пациенты в городских районах обращаются за лечением на уровне учреждения или выше, тогда как 80 процентов нетяжелых пациентов в сельской местности получают лечение на уровне сообщества, а остальные обращаются за лечением на уровне учреждения.
Внедрение стратегий борьбы с ОРИ: уроки опыта
Уроки стратегий профилактики и контроля ОРИ, реализованные в рамках национальных программ, включают стратегии вакцинации и ведения больных, описанные ниже.
Вакцины. Стратегии
Вакцина против Hib была включена в календарь плановой иммунизации младенцев в Северной Америке и Западной Европе в начале 1990-х годов. С созданием Глобального альянса по вакцинам и иммунизации (ГАВИ) и Фонда вакцин был достигнут прогресс в их внедрении в развивающихся странах, хотя серьезные препятствия остаются. К 2002 г. только 84 из 193 стран-членов ВОЗ ввели вакцину против Hib. С тех пор пять стран получили одобрение ГАВИ на поддержку внедрения вакцины против Hib в 2004–2005 годах.
Соединенные Штаты добавили 7-PCV в программу иммунизации младенцев в 2000 году. Некоторые другие промышленно развитые страны планируют включить вакцину в свои национальные программы иммунизации в 2005 году, тогда как другие рекомендуют использовать вакцину только в отдельных группах высокого риска. . В некоторых из этих последних стран определение высокого риска является довольно широким и включает значительную долю всех младенцев. В лицензированном в настоящее время 7-PCV отсутствуют определенные серотипы, важные для развивающихся стран, но 9-PCV и 11-PCV охватывают почти 80 процентов серотипов, вызывающих серьезные заболевания во всем мире.
Несмотря на успех вакцины против Hib в промышленно развитых странах и общепризнанное значение LRI как причины детской смертности, в результате действия ряда взаимосвязанных факторов внедрение вакцины в развивающихся странах было медленным. Устойчивое использование вакцины находится под угрозой в нескольких странах, которые ввели вакцину. Во-первых, масштабы заболеваний и смертей, вызванных Hib, не признаются в этих странах, отчасти из-за недостаточного использования бактериологической диагностики (в результате нехватки оборудования и ресурсов).Во-вторых, поскольку охват, достигнутый с помощью традиционных расширенных программ иммунизации вакцинами, остается низким во многих странах, добавление дополнительных вакцин не было определено в качестве приоритета. В-третьих, развивающиеся страны не предпринимали усилий по установлению полезности вакцины до тех пор, пока вакцина не была лицензирована и не использовалась регулярно в течение нескольких лет в промышленно развитых странах. Следовательно, вакцинация против Hib воспринималась как средство вмешательства для богатых стран. В результате всех этих факторов фактический спрос на вакцину оставался низким, даже когда поддержка предоставлялась через ГАВИ и Фонд вакцин.
В 2004 году правление ГАВИ поручило целевой группе по Hib изучить, как лучше всего поддержать национальные усилия по принятию основанных на фактических данных решений о внедрении вакцины против Hib. На основе рекомендаций целевой группы правление ГАВИ одобрило создание Инициативы против Hib для поддержки тех стран, которые желают либо продолжить вакцинацию против Hib, либо изучить вопрос о том, должно ли внедрение вакцины против Hib быть приоритетом для их систем здравоохранения. Консорциум, состоящий из Школы общественного здравоохранения Блумберга Джонса Хопкинса, Лондонской школы гигиены и тропической медицины, Центров по контролю и профилактике заболеваний и ВОЗ, был выбран для руководства этими усилиями.
Стратегии ведения случаев
Метаанализ исследований Сазавала и Блэка (Sazawal and Black, 2003) на уровне сообществ, посвященных стратегии ведения случаев ОРИ, включает 10 исследований, в которых оценивалось ее влияние на смертность, 7 с одновременной контрольной группой. Метаанализ показал снижение смертности от всех причин на 27 процентов среди новорожденных, на 20 процентов среди младенцев и на 24 процента среди детей в возрасте от одного до четырех лет. Смертность от LRI снизилась на 42, 36 и 36 процентов соответственно. Эти данные ясно показывают, что относительно упрощенное, но стандартизованное ведение случаев ОРИ может иметь значительное влияние на смертность не только от пневмонии, но и от других причин у детей от рождения до четырех лет.В настоящее время стратегия ведения пациентов с ОРИ включена в стратегию ИВБДВ, которая в настоящее время применяется более чем в 80 странах (см. Главу 63).
Несмотря на то, что каждый год из-за пневмонии гибнет огромное количество людей, обещания, заложенные в упрощенном ведении больных, не были успешно реализованы во всем мире. Одна из основных причин — недостаточное использование медицинских учреждений в странах или сообществах, в которых многие дети умирают от ОРИ. В Бангладеш, например, 92 процента больных детей не попадают в соответствующие медицинские учреждения (ВОЗ, 2002 г.).В Боливии 62 процента умерших детей не были доставлены к врачу в случае болезни (Aguilar and others 1998). В Гвинее 61 процент умерших больных детей не были доставлены к врачу (Schumacher and others 2002). Исследование Шелленберга и других (2003), проведенное в Танзании, показывает, что дети из более бедных семей реже получают антибиотики от пневмонии, чем дети из более обеспеченных семей, и что только 41 процент больных детей доставляют в медицинские учреждения.Таким образом, исследования неизменно подтверждают, что больные дети, особенно из бедных семей, не посещают медицинские учреждения.
Ряд стран разработали крупномасштабные и устойчивые программы лечения на уровне сообществ:
- В Гамбии действует национальная программа лечения пневмонии на уровне общин (ВОЗ 2004b).
- В районе Сиая в Кении неправительственная организация эффективно предоставляет медицинскими работниками лечение пневмонии и других детских болезней (ВОЗ, 2004b).
- В Гондурасе управление ОРИ было включено в Национальную интегрированную программу общинного ухода за детьми, в соответствии с которой добровольцы из местных сообществ проводят мониторинг роста, проводят санитарное просвещение и лечат пневмонию и диарею в более чем 1800 сообществах (ВОЗ 2004b).
В Бангладеш Комитет по развитию сельских районов Бангладеш и правительство внедрили программу борьбы с ОРИ, охватывающую 10 подокругов, с привлечением добровольцев из местных медицинских работников. Каждый работник отвечает за лечение детской пневмонии примерно в 100–120 домашних хозяйствах после трехдневной программы обучения.
- В Непале в 1986–89 гг. Общинная программа лечения ОРИ и диарейных заболеваний была протестирована в двух округах и показала существенное снижение смертности от LRI (Pandey and others 1989, 1991). В результате программа была интегрирована в службы здравоохранения Непала и реализуется в 17 из 75 округов страны женщинами-добровольцами, обученными выявлять и лечить пневмонию.
- В Пакистане в программе Lady Health Worker Program работает около 70 000 женщин, которые работают в общинах, обеспечивая образование и ведение детской пневмонии более чем 30 миллионам человек (ВОЗ 2004b).
Программа исследований и разработок
Программа исследований и разработок, изложенная ниже, суммирует приоритеты, установленные консультативными группами Инициативы по исследованиям вакцин (стратегии вмешательства в отношении вакцин) и Отдела ВОЗ по охране здоровья детей и подростков (случай — стратегии управления).
Стратегии вакцинации
Целевая группа ГАВИ по иммунизации против Hib дала ряд рекомендаций, которые различаются в зависимости от страны.Страны, внедрившие вакцину против Hib, должны сосредоточиться на документировании ее эффекта и должны использовать данные для информирования национальных органов власти, партнеров по развитию и других учреждений, занимающихся общественным здравоохранением, для обеспечения постоянной поддержки таких программ вакцинации. Страны, имеющие право на поддержку ГАВИ, которые еще не внедрили вакцины против Hib, часто сталкиваются с ограничениями из-за отсутствия местных данных и недостаточной осведомленности о региональных данных. Они могут решать эти вопросы на субрегиональных встречах, на которых страновые эксперты могут объединять данные и анализировать информацию из других стран.Кроме того, большинству стран необходимо проводить экономический анализ, основанный на стандартизированном инструменте. Наконец, всем странам, которые сталкиваются с высоким бременем Hib-инфекции, необходимо создать лабораторное оборудование, чтобы они могли определять заболеваемость Hib-менингитом в выбранных местах. Страны, в которых бремя болезни остается неясным, могут иметь ограниченные возможности для документирования случаев заболевания Hib с использованием протоколов, основанных на эпиднадзоре за инвазивным менингитом. Им необходимо будет изучить возможности использования альтернативных методов измерения бремени болезней, включая использование исследований вакцины.
Основываясь на опыте внедрения вакцин против Hib и гепатита B, ГАВИ проявил инициативу и в 2003 году на базе Школы общественного здравоохранения Джона Хопкинса в Балтиморе учредил инициативу по реализации программы ускоренной разработки и внедрения пневмококковых вакцин ( PneumoADIP; см. Http://www.preventpneumonia.org). Целью программы является установление и информирование о ценности пневмококковых вакцин и поддержка их доставки. Установление ценности вакцины требует разработки местных данных о бремени болезни и потенциальном воздействии вакцины на здоровье населения.Эти усилия могут быть достигнуты за счет усиленного эпиднадзора за болезнями и соответствующих клинических испытаний в выбранном количестве ведущих стран. После создания доказательная база будет передана лицам, принимающим решения, и ключевым лидерам общественного мнения, чтобы гарантировать принятие решений на основе данных. После того, как будет установлена рентабельность плановой вакцинации, необходимо будет создать системы доставки, и странам потребуется финансовая поддержка, чтобы вакцины могли быть включены в их программы иммунизации.Эти мероприятия инициируются до выпуска вакцин, предназначенных для использования в развивающихся странах, чтобы информировать о планировании потенциала, доступности продуктов и ценообразовании.
Стратегии ведения случаев
В 2003 г. Отдел здоровья детей и подростков ВОЗ созвал совещание для обзора данных и доказательств недавних исследований лечения ОРИ и предложения следующих изменений в руководящие принципы ведения случаев и приоритеты будущих исследований:
- Нетяжелая пневмония:
Повышение специфичности клинических диагностических критериев.
Пересмотреть текущие рекомендуемые ВОЗ критерии для выявления и лечения неудач лечения с учетом высоких показателей неудач терапии.
Проведите повторный анализ данных краткосрочных курсов терапии, чтобы лучше определить факторы, определяющие неэффективность лечения.
Провести плацебо-контролируемые испытания среди детей с хрипом и пневмонией в выбранных условиях с высокой распространенностью хрипов, чтобы определить, нуждаются ли такие дети в антибиотиках.
- Тяжелая пневмония. В рандомизированном клиническом исследовании в контролируемой среде Аддо-Йобо и другие (2004) показали, что пероральный амоксициллин так же эффективен, как парентеральный пенициллин или ампициллин; тем не менее, прежде чем его можно будет рекомендовать в целом, необходимо предпринять следующие действия:
Проанализировать данные об исключениях из исследования.
Определите предикторы, которые могут помочь отличить детей, нуждающихся в госпитализации и у которых впоследствии ухудшается состояние.
Переоценить текущие критерии неэффективности лечения, рекомендованные ВОЗ для тяжелой пневмонии, с учетом общих высоких показателей неэффективности терапии.
Провести описательные исследования в условиях общественного здравоохранения в нескольких центрах по всему миру, чтобы оценить клинические результаты перорального приема амоксициллина у детей в возрасте от 2 до 59 месяцев, у которых наблюдается втягивание нижней грудной стенки.
Задокументировать эффективность руководящих принципов ВОЗ по лечению детей с пневмонией и ВИЧ-инфекцией.
- LRI смертей:
Чтобы помочь разработать более эффективные меры по снижению смертности от LRI, подробно изучите эпидемиологию смертей от LRI в различных регионах, используя рутинные и современные лабораторные методы.
- Кислородная терапия:
Проведите исследования, чтобы показать эффективность кислорода для лечения тяжелых респираторных инфекций.
Соберите базовую информацию о наличии и доставке кислорода и его использовании в больницах в странах с низким уровнем дохода.
Изучите возможности пульсоксиметрии для оптимизации кислородной терапии в различных клинических условиях.
Провести исследования для улучшения специфичности клинических признаков при наложении признаков и симптомов малярии и пневмонии.
Изучите быстрые диагностические тесты на малярию, чтобы оценить их эффективность в различении малярии и пневмонии.
Изучить влияние широкого применения котримоксазола на устойчивость к сульфадоксин-пириметамину к Plasmodium falciparum .
Этиология: Данные об этиологии пневмонии у детей несколько устарели, и необходимы новые этиологические исследования, в которых используются современные технологии для идентификации патогенов.
Выводы: обещания и ловушки
Фактические данные ясно показывают, что подход ВОЗ к ведению больных и более широкое использование имеющихся вакцин снизят смертность от ОРИ среди детей младшего возраста от половины до двух третей. Само по себе систематическое применение упрощенного ведения больных, стоимость которого достаточно низка, чтобы быть доступным практически для любой развивающейся страны, снизит смертность от ОРИ как минимум на треть.Срочно нужно воплотить эту информацию в жизнь.
Стратегия ведения случая должна применяться и проспективно оцениваться, чтобы возникающие проблемы устойчивости к противомикробным препаратам, снижение эффективности текущего лечения рекомендованными противомикробными препаратами или появление неожиданных патогенов могли быть обнаружены на ранней стадии и чтобы можно было быстро принять меры по исправлению положения. Если действия медицинских работников на уровне сообществ будут дополнены внедрением стратегии ИВБДВ на всех уровнях первичной медико-санитарной помощи, то применение и оценка этой стратегии будет проще.Такая синергия также может помочь в сборе информации, которая поможет в дальнейшей точной настройке клинических признаков, чтобы даже сельские медицинские работники могли лучше отличить бронхиолит и хрипы от бактериальной пневмонии. Критике того, что меры по ведению пациентов могут привести к чрезмерному использованию противомикробных препаратов, следует противодействовать путем документального подтверждения их чрезмерного и неправильного использования врачами и другими медицинскими работниками. Хотя наблюдается возрождение интереса к проведению вмешательств на уровне сообществ, наш анализ показывает, что это может оказаться нерентабельным.В самом деле, ведение пациентов с ОРИ в учреждении первого уровня все еще может быть наиболее рентабельным в сочетании с более эффективными поведенческими вмешательствами при обращении за медицинской помощью.
Международное медицинское сообщество только начинает осознавать потенциальные преимущества вакцин против Hib и пневмококка. В настоящее время они дороги по сравнению с вакцинами Расширенной программы иммунизации, но цена вакцины Hib может упасть с выходом на рынок большего числа производителей в ближайшие несколько лет. Тем не менее, убедительные доказательства экономической эффективности вакцин необходимы для облегчения принятия национальных решений по внедрению вакцины и ее устойчивому использованию.В странах с низким уровнем дохода одних только положительных соотношений затрат и выгод и экономической эффективности оказывается недостаточно для включения этих вакцин в национальные программы иммунизации.
Ссылки
- Аддо-Йобо Э., Чисака Н., Хассан М., Хибберд П., Лозано Дж. М., Джина П. и др. Пероральный амоксициллин по сравнению с инъекционным пенициллином при тяжелой пневмонии у детей в возрасте от 3 до 59 месяцев: рандомизированное многоцентровое исследование эквивалентности. Ланцет. 2004. 364 (9440): 1141–48. [PubMed: 15451221]
- Адегбола Р.A., Falade A. G., Sam B. E., Aidoo M., Baldeh I., Hazlett D. et al. Этиология пневмонии у недоедающих и хорошо питающихся детей Гамбии. Журнал детских инфекционных болезней. 1994. 13 (11): 975–82. [PubMed: 7845751]
- Адегбола Р. А., Усен С. О., Вебер М., Ллойд-Эванс Н., Джоб К., Малхолланд К. и др. Haemophilus influenzae Менингит типа B в Гамбии после введения конъюгированной вакцины. Ланцет. 1999; 354 (9184): 1091–92. [PubMed: 10509502]
Агилар, А.М., Р. Альварадо, Д. Кордеро, П. Келли, А. Замора и Р. Сальгадо. 1998 г. Обследование смертности в Боливии: окончательный отчет — исследование и определение причин смерти детей в возрасте до пяти лет . Вена, Вирджиния: Базовая поддержка проекта институционализации выживания детей.
- Берман С. Средний отит у детей. Медицинский журнал Новой Англии. 1995a; 332 (23): 1560–65. [PubMed: 7739711]
- ———. 1995b Отит медиа в развивающихся странах, педиатрия 961, часть 1126–31. [PubMed: 7596700]
Бхаттачарья, К., П. Винч, К. ЛеБан и М. Тьен. 2001. «Стимулы и сдерживающие факторы для работников здравоохранения в сообществе: как они влияют на мотивацию, удержание и устойчивость». Basic Support for Institutionalizing Child Survival Project Агентства США по международному развитию, Арлингтон, Вирджиния.
- Блэк Р. Э., Моррис С. С., Брайс Дж. Где и почему 10 миллионов детей умирают каждый год? Ланцет. 2003. 361 (9376): 2226–34. [PubMed: 12842379]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Льюис Э., Рэй П., Хансен Дж. Р. Группа Центра изучения вакцин Kaiser Permanente Северной Калифорнии. Эффективность, безопасность и иммуногенность гептавалентной пневмококковой конъюгированной вакцины у детей. Журнал детских инфекционных болезней. 2000. 19 (3): 187–95. [PubMed: 10749457]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Хиатт Р. Безопасность, иммуногенность и эффективность олигосахаридного конъюгата у младенцев Haemophilus influenzae Вакцина типа B для населения США: возможные последствия для оптимального использования.Журнал инфекционных болезней. 1992; 165 (Приложение 43): S139–43. [PubMed: 1588149]
- Блэк С. Б., Шайнфилд Х. Р., Хансен Дж., Элвин Л., Лауфер Д., Малиноски Ф. Постлицензионная оценка эффективности семивалентной пневмококковой конъюгированной вакцины. Журнал детских инфекционных болезней. 2001. 20 (12): 1105–7. [PubMed: 11740313]
- Бобат Р., Кувадия Х. М., Мудли Д., Коутсудис А. Смертность в когорте детей, рожденных ВИЧ-инфицированными женщинами из Дурбана, Южная Африка. Южноафриканский медицинский журнал.1999. 89 (6): 646–48. [PubMed: 10443216]
- Booy R., Hodgson S., Carpenter L., Mayon-White R. T., Slack M. P., Macfarlane J. A. et al. Эффективность Haemophilus influenzae PRP-T конъюгированной вакцины типа B. Ланцет. 1994. 344 (8919): 362–66. [PubMed: 7 6]
- Брайс Дж., Боски-Пинто К., Сибуя К., Блэк Р. Э. Справочная группа ВОЗ по эпидемиологии здоровья детей. . Оценки ВОЗ причин смерти у детей. Ланцет. 2005; 365: 1147–52. [PubMed: 15794969]
- Кэмпбелл Х., Армстронг Дж. Р. М., Байасс П. Загрязнение воздуха в помещениях в развивающихся странах и острая респираторная инфекция у детей. Ланцет. 1989; 1 (8645): 1012. [PubMed: 2565480]
- Кэмпбелл Х., Байасс П., Ламонт А. С., Форги И. М., О’Нил К. П., Ллойд-Эанс Н., Гринвуд Б. М. Оценка клинических критериев для выявления тяжелых острых инфекций нижних дыхательных путей у детей. Ланцет. 1989; 1 (8633): 297–99. [PubMed: 2563457]
- Группа изучения догоняющих событий. Клиническая эффективность ко-тримоксазола по сравнению с амоксициллином дважды в день для лечения пневмонии: рандомизированное контролируемое клиническое испытание в Пакистане.Архив болезней детства. 2002; 86: 113–18. [Бесплатная статья PMC: PMC1761064] [PubMed: 11827905]
- Cherian T., John T. J., Simoes E. A., Steinhoff M. C., John M. Оценка простых клинических признаков для диагностики острой инфекции нижних дыхательных путей. Ланцет. 1988. 2: 125–28. [PubMed: 2899187]
- Cherian T., Simoes E. A., Steinhoff M. C., Chitra K., John M., Raghupathy P. et al. Бронхиолит в тропической южной Индии. Американский журнал болезней детей. 1990; 144 (9): 1026–30.[PubMed: 2396617]
- Каттс Ф. Т., Заман С. М. А., Энвере Г., Джаффар С., Левин О. С., Ококо Дж. Б. и др. Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное, двойное слепое, плацебо-контролируемое испытание. Ланцет. 2005; 365 (9465): 1139–46. [PubMed: 15794968]
- де Андраде А. Л., де Андраде Дж. Г., Мартелли К. М., Сильва С. А., де Оливейра Р. М., Коста М. С. и др. Эффективность конъюгированной вакцины Haemophilus influenzae B при детской пневмонии: исследование случай-контроль в Бразилии.Международный журнал эпидемиологии. 2004. 33 (1): 173–81. [PubMed: 15075166]
- Денни Ф. У. мл. Клиническое влияние респираторных вирусных инфекций человека. Американский журнал респираторной медицины и реанимации. 1995; 152 (4, часть 2): S4–12. [PubMed: 7551411]
- Dobson M. Концентраторы кислорода обеспечивают экономию средств для развивающихся стран: исследование, основанное на Новой Гвинее. Анестезия. 1991; 146: 217–19. [PubMed: 2014901]
- Дуглас Р. М., Майлз Х. Б. Вакцинация против Streptococcus pneumoniae в детстве: отсутствие очевидной пользы для маленьких австралийских детей.Журнал инфекционных болезней. 1984. 149 (6): 861–69. [PubMed: 6376653]
- Герцог Т., Мгоне Дж., Фрэнк Д. Гипоксемия у детей с тяжелой пневмонией в Папуа-Новой Гвинее. Международный журнал туберкулеза и болезней легких. 2001; 5: 511–19. [PubMed: 11409576]
- Эскола Дж., Кайхти Х., Такала А. К., Пелтола Х., Роннберг П. Р., Кела Э. и др. Рандомизированное проспективное полевое испытание конъюгированной вакцины для защиты младенцев и детей младшего возраста от инвазивной болезни Haemophilus influenzae типа B.Медицинский журнал Новой Англии. 1990. 323 (20): 1381–87. [PubMed: 2233904]
- Eskola J., Kilpi T., Palmu A., Jokinen J., Haapakoski J., Herva E. et al. Эффективность пневмококковой конъюгированной вакцины против острого среднего отита. Медицинский журнал Новой Англии. 2001. 344 (6): 403–409. [PubMed: 11172176]
- Фарли Дж., Кинг Дж. К., Наир П., Хайнс С. Э., Трессиер Р. Л., Винк П. Э. Инвазивное пневмококковое заболевание среди инфицированных и неинфицированных детей матерей с инфекцией, вызванной вирусом иммунодефицита человека.Журнал педиатрии. 1994; 124: 853–58. [PubMed: 8201466]
- Фиддиан-Грин Р. Г., Бейкер С. Нозокомиальная пневмония у критически больных: продукт аспирации или перемещения? Реанимационная медицина. 1991; 19: 763–69. [PubMed: 2055052]
- Файерман Б., Блэк С. Б., Шайнфилд Х. Р., Ли Дж., Льюис Э., Рэй П. Воздействие пневмококковой конъюгированной вакцины на средний отит. Журнал детских инфекционных болезней. 2003. 22 (1): 10–16. [PubMed: 12544402]
- Фритцелл Б., Плоткин С. Эффективность и безопасность вакцины, конъюгированной с капсульным полисахаридом столбняка и белком столбняка, Haemophilus influenzae.Журнал педиатрии. 1992. 121 (3): 355–62. [PubMed: 1517908]
- Гесснер Б. Д., Сутанто А., Линехан М., Джелантик И. Г., Флетчер Т., Герудуг И. К. и др. Заболеваемость гемофильной пневмонией и менингитом, предотвращаемым вакцинацией, Haemophilus Influenzae у индонезийских детей: рандомизированное исследование вакцины Hamlet. Ланцет. 2005; 365 (9453): 43–52. [PubMed: 15643700]
- Гафур А., Номани Н. К., Исхак З., Заиди С. З., Анвар Ф., Берни М. И. и др. Диагностика острых инфекций нижних дыхательных путей у детей в Равалпинди и Исламабаде, Пакистан.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S907–14. [PubMed: 2270413]
- Гилкс К. Ф. Пневмококковая болезнь и ВИЧ-инфекция. Анналы внутренней медицины. 1993; 118: 393–94. [PubMed: 8430986]
- Гоэль А., Бэмфорд Л., Хансло Д., Хасси Г. Первичная стафилококковая пневмония у детей раннего возраста: обзор 100 случаев. Журнал тропической педиатрии. 1999. 45 (4): 233–36. [PubMed: 10467836]
- Hament J. M., Aerts P. C., Fleer A., Van Dijk H., Harmsen T., Kimpen J. L., Wolfs T.F. Повышенная адгезия Streptococcus pneumoniae к эпителиальным клеткам человека, инфицированным респираторно-синцитиальным вирусом. Педиатрические исследования. 2004; 55 (6): 972–78. [PubMed: 15103015]
- Heath P. T. Haemophilus influenzae Конъюгированные вакцины типа B: обзор данных об эффективности. Журнал детских инфекционных болезней. 1998. 17 (9 доп.): S117–22. [PubMed: 9781743]
- Hortal M., Mogdasy C., Russi J. C., Deleon C., Suarez A. Микробные агенты, ассоциированные с пневмонией у детей из Уругвая.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S915–22. [PubMed: 2270414]
- Икеогу М. О., Вольф Б., Мате С. Легочные проявления у ВИЧ-серопозитивных и недоедающих детей в Зимбабве. Архив болезней детства. 1997. 76: 124–28. [Бесплатная статья PMC: PMC1717076] [PubMed:
- 01]
- Джина П. М., Кувадия Х. М., Кристал В. Pneumocystis carinii и cytomegalo Вирусные инфекции у тяжелобольных ВИЧ-инфицированных африканских младенцев. Анналы тропической педиатрии.1996; 16: 361–68. [PubMed: 8985536]
- Цзян З., Нагата Н., Молина Э., Бакалетз Л. О., Хокинс Х., Патель Дж. А. Усиленное прикрепление нетипируемого Haemophilus influenzae , инфицированного респираторно-синцитиальным вирусом, к респираторным эпителиальным клеткам, инфицированным синцитиальным вирусом. Инфекция и иммунитет. 1999; 67: 187–92. [Бесплатная статья PMC: PMC96295] [PubMed: 9864214]
Джон Т. Дж. 1994. «Кто определяет национальную политику здравоохранения?» In Вакцинация и здоровье в мире: четвертый ежегодный форум общественного здравоохранения Лондонской школы гигиены и тропической медицины , изд.Каттс Ф. Т., Смит П. Г., 205–11. Чичестер, Великобритания: Джон Вили.
- Джон Т. Дж., Чериан Т., Стейнхофф М. К., Симоэс Э. А., Джон М. Этиология острых респираторных инфекций у детей в тропиках на юге Индии. Обзоры инфекционных болезней. 1991; 13 (Приложение 6): S463–69. [PubMed: 1862277]
- Камат К. Р., Фельдман Р. А., Рао П. С., Уэбб Дж. К. Инфекция и болезнь в группе южноиндийских семей. Американский журнал эпидемиологии. 1969; 89: 375–83. [PubMed: 5778926]
- Карма П., Луотонен Дж., Тимонен М., Понтинен С., Пукандер Дж., Херва Э. и др. Эффективность пневмококковой вакцины против рецидивирующего среднего отита: предварительные результаты полевых испытаний в Финляндии. Annals of Otology, Rhinology, and Laryngology Suppl. 1980. 89 (3, часть 2): 357–62. [PubMed: 6778346]
Картасасмита, С. 2003. «Пероральный котримоксазол три или пять дней при нетяжелой пневмонии». Документ, представленный на Консультативном совещании Всемирной организации здравоохранения по обзору текущих исследований и лечению острых респираторных инфекций, Женева, 29 сентября — 1 октября.
- Килпи Т., Ахман Х., Йокинен Дж., Ланкинен К. С., Палму А., Саволайнен Х. и др. Защитная эффективность второй пневмококковой конъюгированной вакцины против пневмококкового острого среднего отита у младенцев и детей: рандомизированное контролируемое испытание семивалентной конъюгированной вакцины комплекса пневмококкового полисахарида и менингококкового белка внешней мембраны с 7-валентными соединениями у 1666 детей. Клинические инфекционные болезни. 2003. 37 (9): 1155–64. [PubMed: 14557958]
- Клугман К. П., Мадхи С. А., Хюбнер Р.E., Kohberger R., Mbelle N., Pierce N. et al. Испытание пневмококковой конъюгированной вакцины 9-Valent у детей с ВИЧ-инфекцией и без нее. Медицинский журнал Новой Англии. 2003. 349 (14): 1341–48. [PubMed: 14523142]
- Колстад П. Р., Бернем Г., Калтер Х. Д., Кения-Мугиша Н., Блэк Р. Э. Комплексное ведение детских болезней в Западной Уганде. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 77–85. [Бесплатная статья PMC: PMC2486998] [PubMed: 9529720]
- Lagos R., Хорвиц И., Торо Дж., Сан Мартин О., Абрего П., Бустаманте С. и др. Крупномасштабная, постлицензионная, селективная вакцинация чилийских младенцев конъюгированной вакциной PRP-T: практичность и эффективность в предотвращении инвазивных инфекций Haemophilus influenzae типа B. Журнал детских инфекционных болезней. 1996; 15: 216–22. [PubMed: 8852909]
- Леманн Д., Маршалл Т. Ф., Райли И. Д., Альперс М. П. Влияние пневмококковой вакцины на заболеваемость острыми инфекциями нижних дыхательных путей у детей Папуа-Новой Гвинеи.Анналы тропической педиатрии. 1991. 11 (3): 247–57. [PubMed: 1719924]
- Левин О. С., Лагос Р., Муньос А., Вильяроэль Дж., Альварес А. М., Абрего П. и др. Определение бремени пневмонии у детей, которую можно предотвратить с помощью вакцинации против Haemophilus influenzae Тип B. Журнал детских инфекционных болезней. 1999. 18 (12): 1060–64. [PubMed: 10608624]
- Лукас С. Б., Пикок С. С., Хунноу А., Браттегаард К., Коффи К., Хонд М. и др. Заболевание детей, инфицированных ВИЧ в Абиджане, Кот-д’Ивуар.Британский медицинский журнал. 1996; 312: 335–38. [Бесплатная статья PMC: PMC2350283] [PubMed: 8611829]
- Мадхи С.А., Петерсен К., Мадхи А., Хосал М., Клугман К.П. Повышенное бремя болезней и устойчивость бактерий к антибиотикам, вызывающая тяжелые инфекции нижних дыхательных путей, приобретенные в сообществе Дети, инфицированные вирусом иммунодефицита человека 1. Клинические инфекционные болезни. 2000. 31: 170–76. [PubMed: 10
- 7]
- Мадхи С. А., Петерсен К., Мадхи А., Васас А., Клугман К. П.Влияние вируса иммунодефицита человека типа 1 на спектр заболеваний Streptococcus pneumoniae у детей Южной Африки. Журнал детских инфекционных болезней. 2000. 19 (12): 1141–47. [PubMed: 11144373]
- Макела П. Х., Сибаков М., Херва Э., Хенрихсен Дж., Луотонен Дж., Тимонен М. и др. Пневмококковая вакцина и средний отит. Ланцет. 1980; 2 (8194): 547–51. [PubMed: 6106735]
Управленческие науки для здравоохранения. 2005. Международный справочник по индикаторам цен на лекарства .Кембридж, Массачусетс: Управленческие науки для здоровья.
- МакКуллерс Дж. А., Бартмесс К. С. Роль нейраминидазы в летальном синергизме между вирусом гриппа и Streptococcus pneumoniae . Журнал инфекционных болезней. 2003. 187: 1000–9. [PubMed: 12660947]
- Монто А. С., Ульман Б. М. Острое респираторное заболевание в американском сообществе: исследование Текумсе. Журнал Американской медицинской ассоциации. 1974. 227 (2): 164–69. [PubMed: 4357298]
- Малхолланд К., Усен С., Адегбола Р., Вебер Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998. 352 (9127): 575–76. [PubMed: 9716087]
- Малхолланд Э. К., Симоэс Э. А., Касталес М. О., МакГрат Э. Дж., Маналак Э. М., Гоув С. Стандартизированная диагностика пневмонии в развивающихся странах. Журнал детских инфекционных болезней. 1992; 11: 77–81. [PubMed: 1741202]
- Малхолланд К., Хилтон С., Адегбола Р., Усен С., Опарауго А., Омосиго С. и др. Рандомизированное исследование Haemophilus influenzae вакцины конъюгированной против столбняка с белком типа B для профилактики пневмонии и менингита у младенцев в Гамбии.Ланцет. 1997. 349 (9060): 1191–97. [PubMed:
- 39]
- Натху К. Дж., Нкрума Ф. К., Ндлову Д., Нхембе Д., Пири Дж., Ково Х. Острая инфекция нижних дыхательных путей у госпитализированных детей в Зимбабве. Анналы тропической педиатрии. 1993; 13: 253–61. [PubMed: 7505550]
- Нойзил К. М., Чжу Ю., Гриффин М. Р., Эдвардс К. М., Томпсон Дж. М., Толлефсон С. Дж., Райт П. Ф. Бремя межпандемического гриппа у детей младше 5 лет: 25-летнее перспективное исследование. Журнал инфекционных болезней.2002; 185: 147–52. [PubMed: 11807687]
- Nolan T., Angos P., Cunha A. J., Muhe L., Qazi S., Simoes E. A. et al. Качество стационарной помощи тяжелобольным детям в менее развитых странах. Ланцет. 2001. 357 (9250): 106–10. [PubMed: 11197397]
- Обаро С., Лич А., Макадам К. В. Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998; 352 (9127): 575. [PubMed: 9716086]
- О’Брайен К. Л., Моултон Л. Х., Рид Р., Уэзерхольц Р., Оски Дж., Браун Л. и др. Эффективность и безопасность семивалентной конъюгированной пневмококковой вакцины у детей американских индейцев: групповое рандомизированное исследование.Ланцет. 2003. 362 (9381): 355–61. [PubMed: 12 8]
- Оньянго Ф. Э., Стейнхофф М. К., Вафула Э. М., Вариуа С., Мусиа Дж., Китони Дж. Гипоксемия у маленьких кенийских детей с острой инфекцией нижних дыхательных путей. Британский медицинский журнал. 1993. 306 (6878): 612–15. [Бесплатная статья PMC: PMC1676956] [PubMed: 8369033]
- Пандей М. Р., Даулер Н. М., Старбак Э. С., Хьюстон Р. М., Макферсон К. Снижение общей смертности детей в возрасте до пяти лет в Западном Непале с помощью противомикробного лечения пневмонии на уровне местных сообществ.Ланцет. 1991. 338 (8773): 993–97. [PubMed: 1681351]
- Пандей М. Р., Шарма П. Р., Губхаджу Б. Б., Шакья Г. М., Неупане Р. П., Гаутам А. и др. Воздействие пилотной программы борьбы с острыми респираторными инфекциями (ОРИ) в сельском сообществе Горного региона Непала. Анналы тропической педиатрии. 1989. 9 (4): 212–20. [PubMed: 2482002]
- Педерсон Дж., Найроп М. Анестезиологическое оборудование для развивающихся стран. Британский журнал анестезии. 1991; 66: 264–70. [PubMed: 1817634]
- Пейрис Дж.S., Yu W. C., Leung C. W., Cheung C. Y., Ng W. F., Nicholls J. M. et al. Повторное появление заболевания подтипа H5N1 гриппа человека со смертельным исходом. Ланцет. 2004; 363 (9409): 617–19. [Бесплатная статья PMC: PMC7112424] [PubMed: 14987888]
- Перкинс Б. А., Цукер Дж. Р., Отинео Дж., Джафари Х. С., Пакстон Л., Редд С. С. и др. Оценка алгоритма интегрированного ведения детских болезней в районе Кении с высоким уровнем передачи малярии. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 33–42.[Бесплатная статья PMC: PMC2487004] [PubMed: 9529716]
Киамбао, Б. П., Э. А. Симоес, Э. Абучехо-Ладесма, Л. С. Гозум, С. П. Луписан, Л. Т. Сомбреро и П. Дж. Рууту (Консорциум ARIVAC). Скоро. «Серьезные детские инфекции, приобретенные в сообществе, в сельских районах Азии (остров Бохол, Филиппины)». Журнал детских инфекционных болезней .
Редд С. Диагностика и лечение острых респираторных инфекций в Лесото. Политика и управление здравоохранением. 1994; 5: 255–60.
- Райли И. Д., Эверингем Ф. А., Смит Д. Э., Дуглас Р. М. Иммунизация поливалентной пневмококковой вакциной: влияние респираторной смертности у детей, живущих в Высокогорье Новой Гвинеи. Архив болезней детства. 1981. 56 (5): 354–57. [Бесплатная статья PMC: PMC1627425] [PubMed: 7020609]
- Райли И. Д., Леманн Д., Альперс М. П. Испытания пневмококковой вакцины в Папуа-Новой Гвинее: взаимосвязь между эпидемиологией пневмококковой инфекции и эффективностью вакцины. Обзоры инфекционных болезней.1991; 13 (Приложение 6): S535–41. [PubMed: 1862283]
- Рудан И., Томаскович Л., Боски-Пинто К., Кэмпбелл Х. Справочная группа ВОЗ по эпидемиологии здоровья детей. Глобальная оценка заболеваемости клинической пневмонией среди детей в возрасте до пяти лет. Бюллетень Всемирной организации здравоохранения. 2004. 82 (12): 895–903. [Бесплатная статья PMC: PMC2623105] [PubMed: 15654403]
Рудан и другие. Скоро.
- Santosham M., Wolff M., Reid R., Hohenboken M., Bateman M., Goepp J.и другие. Эффективность конъюгированной вакцины, состоящей из Haemophilus influenzae типа B и Neisseria meningitidis Внешнемембранного белкового комплекса, у младенцев навахо. Медицинский журнал Новой Англии. 1991. 324 (25): 1767–72. [PubMed: 1
6]
- Сазавал С., Блэк Р. Е. Группа исследований по ведению больных с пневмонией: влияние ведения больных с пневмонией на смертность новорожденных, младенцев и детей дошкольного возраста — метаанализ испытаний на уровне сообществ. Ланцетные инфекционные болезни.2003; 3: 547–56. [PubMed: 12954560]
- Schellenberg J. A., Victora C.G., Mushi A., de Savigny D., Schellenberg D., Mshinda H. et al. Неравенство среди очень бедных: здравоохранение для детей в сельских районах Южной Танзании. Ланцет. 2003. 361 (9357): 561–66. [PubMed: 12598141]
- Шнайдер Г. Обеспечение кислородом в сельских районах Африки: личный опыт. Международный журнал туберкулеза и болезней легких. 2001. 5 (6): 524–26. [PubMed: 11409578]
Шумахер, Р., Э. Сведберг, М.О. Диалло, Д. Р. Кейта, Х. Кальтер, О. Паша. 2002. Исследование смертности в Гвинее: исследование причин смерти детей в возрасте до пяти лет . Арлингтон, Вирджиния: Спасите детей и базовая поддержка для институционализации проекта выживания детей.
- Шэнн Ф. Этиология тяжелой пневмонии у детей в развивающихся странах. Детская инфекционная болезнь. 1986. 5 (2): 247–52. [PubMed: 3952013]
- Шенн Ф., Граттен М., Гермер С., Линнеманн В., Хазлетт Д., Пейн Р. Этиология пневмонии у детей в больнице Горока, Папуа-Новая Гвинея.Ланцет. 1984; 2 (8402): 537–41. [PubMed: 6147602]
- Шэнн Ф., Харт К., Томас Д. Острые инфекции нижних дыхательных путей у детей: возможные критерии отбора пациентов для антибактериальной терапии и госпитализации. Бюллетень Всемирной организации здравоохранения. 1984; 62: 749–51. [Бесплатная статья PMC: PMC2536213] [PubMed: 6334573]
- Simoes E. A. Респираторно-синцитиальная вирусная инфекция. Ланцет. 1999. 354 (9181): 847–52. [PubMed: 10485741]
- Симоэс Э. А., Деста Т., Тессема Т., Gerbresellassie T., Dagnew M., Gove S. Эффективность медицинских работников после обучения комплексному ведению детских болезней в Гондэре, Эфиопия. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 43–53. [Бесплатная статья PMC: PMC2487005] [PubMed: 9529717]
- Слойер Дж. Л. Дж., Плуссард Дж. Х., Хоуи В. М. Эффективность пневмококковой полисахаридной вакцины в предотвращении острого среднего отита у младенцев в Хантсвилле, Алабама. Обзоры инфекционных болезней. 1981; 3 (Прил.): S119–23. [PubMed: 7280444]
- Стенсбаль Л.Г., Девасундарам Дж. К., Симоэс Э. А. Эпидемии респираторно-синцитиального вируса: взлеты и падения сезонного вируса. Журнал детских инфекционных болезней. 2003; 22 (2 доп.): S21–32. [PubMed: 12671449]
- Штраус В. Л., Кази С. А., Кунди З., Номани Н. К., Шварц Б. Группа по изучению ко-тримоксазола. Устойчивость к противомикробным препаратам и клиническая эффективность ко-тримоксазола по сравнению с амоксициллином при пневмонии у детей в Пакистане: рандомизированное контролируемое исследование. Ланцет. 1998. 352: 270–74. [PubMed: 96]
- Темпл К., Гринвуд Б., Инскип Х., Холл А., Коскела М., Лейнонен М. Ответ антител на пневмококковую капсульную полисахаридную вакцину у африканских детей. Журнал детских инфекционных болезней. 1991. 10 (5): 386–90. [PubMed: 2067888]
- Тупаси Т. Э., Лусеро М. Г., Магдангал Д. М., Мангубат Н. В., Сунико М. Э., Торрес К. У. и др. Этиология острой инфекции нижних дыхательных путей у детей из Алабанга, Метро Манила. Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S929–39. [PubMed: 2270415]
ЮНЭЙДС (Объединенная программа Организации Объединенных Наций по ВИЧ / СПИДу).2002. Обновление эпидемии СПИДа . Женева: ЮНЭЙДС.
- Усен С., Вебер М., Малхолланд К., Джаффар С., Опарауго А., Омосиго С. и др. Клинические предикторы гипоксемии у детей Гамбии с острой инфекцией нижних дыхательных путей: проспективное когортное исследование. Британский медицинский журнал. 1999. 318 (7176): 86–91. [Бесплатная статья PMC: PMC27680] [PubMed: 9880280]
- Van den Hoogen BG, de Jong JC, Groen J., Kuiken T., de Groot R., Fouchier RA, Osterhaus AD Недавно обнаруженный человеческий пневмовирус, выделенный у детей раннего возраста при заболевании дыхательных путей.Природная медицина. 2001; 7: 719–24. [Бесплатная статья PMC: PMC7095854] [PubMed: 11385510]
- Вуори-Холопайнен Э., Пелтола Х. Переоценка легочного легочного: обзор старого метода для лучшей этиологической диагностики детской пневмонии. Клинические инфекционные болезни. 2001. 32 (5): 715–26. [PubMed: 11229839]
- Вебер М. В., Малхолланд Э. К., Джаффар С., Трёдссон Х., Гоув С., Гринвуд Б. М. Оценка алгоритма комплексного ведения детских болезней в районе с сезонной малярией в Гамбии.Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 25–32. [Бесплатная статья PMC: PMC2486992] [PubMed: 9529715]
- Венгер Дж. Д., ДиФабио Дж., Ландаверде Дж. М., Левин О. С., Гаафар Т. Внедрение конъюгированных вакцин против Hib в непромышленно развитых странах: опыт в четырех странах, которые «недавно начали принимать» . Вакцина. 1999. 18 (78): 736–42. [PubMed: 10547434]
Wenger, J. D., and M. M. Levine, eds. 1997. Эпидемиологическое влияние конъюгированной вакцины на инвазивное заболевание, вызываемое гемофильной палочкой Haemophilus influenzae Тип B .Нью-Йорк: Марсель Деккер.
- Уитни К. Г., Фарли М. М., Хадлер Дж., Харрисон Л. Х., Беннет Н. М., Линфилд Р. и др. Снижение инвазивного пневмококкового заболевания после введения протеин-полисахаридной конъюгированной вакцины. Медицинский журнал Новой Англии. 2003. 348 (18): 1737–46. [PubMed: 12724479]
ВОЗ (Всемирная организация здравоохранения). 1990. «Антибиотики в лечении острых респираторных инфекций у детей раннего возраста». Неопубликованный документ WHO / ARI / 90.10, доступный по запросу в Отделе здоровья и развития детей, бывшего Отдела борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 1991. «Ведение маленького ребенка с острой респираторной инфекцией. Модуль обучения навыкам супервизии». Неопубликованный документ, доступный по запросу в Отделе здоровья и развития детей ВОЗ, бывшем Отделении борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 2002. Многострановая оценка эффективности, затрат и воздействия ИВБДВ (MCE): отчет о ходе работы, май 2001 г. — апрель 2002 г. .WHO / FCH / CAH / 02.16. Женева: Отдел здоровья и развития детей и подростков, ВОЗ.
———. 2003 г. Консультативное совещание по ведению детей с пневмонией и ВИЧ-инфекцией, 30–31 января 2003 г., Хараре, Зимбабве . WHO / FCH / CAH / 03.4. Женева: ВОЗ.
- ———. 2004a Группа по обзору Haemophilus influenzae Бремя болезни типа B (Hib) в Бангладеш, Индонезия и других азиатских странах, Бангкок, 28–29 января 2004 г. Еженедельный эпидемиологический отчет 79 (18): 173–75.[PubMed: 15168565]
———. 2004b. «Совместное заявление ВОЗ / ЮНИСЕФ: ведение пневмонии в общественных местах». WHO / FCH / CAG / 04.06. ВОЗ, Женева.
ВОЗ (Всемирная организация здравоохранения) и здоровье детей-подростков. Скоро. Отчет о методологии и предположениях, использованных для оценки затрат на расширение отдельных мероприятий по охране здоровья детей до 95% с целью снижения смертности детей в возрасте до пяти лет . Женева: ВОЗ.
- Уильямс Б. Г., Гоус Э., Боски-Пинто К., Брайс Дж., Дай С. Оценки глобального распределения детской смертности от острых респираторных инфекций. Ланцетные инфекционные болезни. 2002; 2: 25–32. [PubMed: 118]
Всемирный банк. 2002. Показатели мирового развития . CD-ROM. Вашингтон, округ Колумбия: Всемирный банк.
- Цви К. Дж., Петтифиор Дж. М., Содерлунд Н. Педиатрическая больница при городской региональной больнице Южной Африки: влияние ВИЧ, 1992–1997. Анналы тропической педиатрии. 1999; 19: 135–42. [PubMed: 106]
Острые респираторные инфекции у детей — приоритеты борьбы с заболеваниями в развивающихся странах
Острые респираторные инфекции (ОРИ) классифицируются как инфекции верхних дыхательных путей (URI) или инфекции нижних дыхательных путей (LRIs).Верхние дыхательные пути состоят из дыхательных путей от ноздрей до голосовых связок в гортани, включая придаточные пазухи носа и среднее ухо. Нижние дыхательные пути покрывают продолжение дыхательных путей от трахеи и бронхов к бронхиолам и альвеолам. ОРИ не ограничиваются дыхательными путями и имеют системные эффекты из-за возможного распространения инфекции или микробных токсинов, воспаления и снижения функции легких. Дифтерия, коклюш (коклюш) и корь — это болезни, которые можно предотвратить с помощью вакцин, которые могут иметь компонент дыхательных путей, но также влияют на другие системы; они обсуждаются в главе 20.
За исключением неонатального периода, ОРИ являются наиболее частой причиной как болезней, так и смертности у детей в возрасте до пяти лет, у которых в среднем от трех до шести эпизодов ОРИ ежегодно, независимо от того, где они живут или каково их экономическое положение (Kamath and others 1969; Монто и Ульман 1974). Тем не менее, соотношение легких и тяжелых заболеваний варьируется между странами с высоким и низким уровнем доходов, и из-за различий в конкретной этиологии и факторах риска тяжесть LRIs у детей в возрасте до пяти лет хуже в развивающихся странах, что приводит к более высокому уровню заболеваемости. летальность.Хотя медицинская помощь может до некоторой степени снизить как тяжесть заболевания, так и летальный исход, многие тяжелые формы LRI не поддаются лечению, в основном из-за отсутствия высокоэффективных противовирусных препаратов. Ежегодно умирает около 10,8 миллиона детей (Black, Morris, and Bryce, 2003). По оценкам, в 2000 году 1,9 миллиона из них умерли от ОРИ, 70 процентов из них — в Африке и Юго-Восточной Азии (Williams and others 2002). По оценкам Всемирной организации здравоохранения (ВОЗ), 2 миллиона детей в возрасте до пяти лет умирают от пневмонии ежегодно (Bryce and others 2005).
Причины ОРИ и бремя болезней
ОРИ у детей уносят тяжелый урон жизни, особенно там, где медицинская помощь недоступна или за ней не обращаются.
Инфекции верхних дыхательных путей
URI являются наиболее распространенными инфекционными заболеваниями. К ним относятся ринит (простуда), синусит, инфекции уха, острый фарингит или тонзиллофарингит, эпиглоттит и ларингит, из которых инфекции уха и фарингит вызывают более серьезные осложнения (глухота и острая ревматическая лихорадка соответственно).Подавляющее большинство URI имеют вирусную этиологию. Риновирусы составляют от 25 до 30 процентов URI; респираторно-синцитиальные вирусы (РСВ), вирусы парагриппа и гриппа, метапневмовирус человека и аденовирусы — от 25 до 35 процентов; вирусы короны на 10 процентов; и неопознанные вирусы для остальных (Denny 1995). Поскольку большинство URI являются самоограничивающимися, их осложнения более важны, чем инфекции. Острые вирусные инфекции предрасполагают детей к бактериальным инфекциям носовых пазух и среднего уха (Berman 1995a), а аспирация инфицированных секретов и клеток может приводить к LRIs.
Острый фарингит
Острый фарингит у детей младшего возраста более чем в 70% случаев вызывается вирусами. Типичны легкое покраснение глотки, отек и увеличение миндалин. Стрептококковая инфекция редко встречается у детей до пяти лет и более часто встречается у детей старшего возраста. В странах с многолюдными условиями жизни и группами населения, которые могут иметь генетическую предрасположенность, постстрептококковые последствия, такие как острый ревматизм и кардит, распространены у детей школьного возраста, но могут также возникать у детей младше пяти лет.Острый фарингит в сочетании с развитием перепонки в горле почти всегда вызывается в развивающихся странах Corynebacterium diphtheriae . Однако при почти повсеместной вакцинации младенцев вакциной АКДС (дифтерия-столбняк-коклюш) дифтерия встречается редко.
Острая ушная инфекция
Острая ушная инфекция встречается у 30 процентов URI. В развивающихся странах с неадекватной медицинской помощью это может привести к перфорации барабанных перепонок и хроническим выделениям из уха в более позднем детстве и, в конечном итоге, к ухудшению слуха или глухоте (Berman 1995b).Хроническая ушная инфекция после повторных эпизодов острой ушной инфекции распространена в развивающихся странах, поражая от 2 до 6 процентов детей школьного возраста. Связанная с этим потеря слуха может приводить к инвалидности и влиять на обучение. Повторные ушные инфекции могут привести к мастоидиту, который, в свою очередь, может распространить инфекцию на мозговые оболочки. Мастоидит и другие осложнения, вызванные ОРВИ, являются причиной почти 5 процентов всех смертей от ОРИ во всем мире (Williams и др., 2002).
Инфекции нижних дыхательных путей
Распространенными инфекциями нижних дыхательных путей у детей являются пневмония и бронхиолит.Частота дыхания является ценным клиническим признаком для диагностики острой ЛРН у кашляющих и учащенно дышащих детей. Наличие втягивания нижней грудной стенки указывает на более тяжелое заболевание (Mulholland и др., 1992; Shann, Hart, and Thomas 1984).
В настоящее время наиболее частыми причинами вирусных LRIs являются RSV. Они, как правило, очень сезонные, в отличие от вирусов парагриппа, следующей наиболее частой причины вирусных LRI. Эпидемиология вирусов гриппа у детей в развивающихся странах заслуживает срочного исследования, поскольку доступны безопасные и эффективные вакцины.До эффективного использования противокоревой вакцины вирус кори был самой важной вирусной причиной заболеваемости и смертности детей, связанных с респираторными путями, в развивающихся странах.
Пневмония
И бактерии, и вирусы могут вызывать пневмонию. Бактериальная пневмония часто вызывается Streptococcus pneumoniae (пневмококк) или Haemophilus influenzae, в основном типом b (Hib) и иногда Staphylococcus aureus или другими стрептококками.Всего от 8 до 12 из множества типов пневмококка вызывают большинство случаев бактериальной пневмонии, хотя конкретные типы могут различаться у взрослых и детей и в разных географических регионах. Другие патогены, такие как Mycoplasma pneumoniae и Chlamydia pneumoniae, , вызывают атипичные пневмонии. Их роль как причины тяжелых заболеваний у детей до пяти лет в развивающихся странах неясна.
Бремя LRIs, вызванного Hib или S. pneumoniae , трудно определить, поскольку современные методы установления бактериальной этиологии не обладают чувствительностью и специфичностью.Результаты посева из глотки не всегда позволяют выявить патоген, являющийся причиной LRI. Бактериальные культуры образцов аспирата легких часто считаются золотым стандартом, но они не подходят для применения в полевых условиях. Обзор нескольких исследований Вуори-Холопайнен и Пелтола (2001) показывает, что на S. pneumoniae и Hib приходится от 13 до 34 процентов и от 1,4 до 42,0 процентов бактериальных пневмоний, соответственно, тогда как исследования Адегбола и др. (1994), Шэнн, Граттен и другие (1984) и Уолл и другие (1986) предполагают, что Hib составляет от 5 до 11 процентов случаев пневмонии.
Пониженные уровни клинической или радиологической пневмонии при клинических испытаниях девятивалентной пневмококковой конъюгированной вакцины дают оценку бремени болезней, предупреждаемых с помощью вакцины ( валентность указывает количество серотипов, от которых вакцина обеспечивает защиту; конъюгат относится к конъюгации полисахаридов с белковым остовом). В исследовании, проведенном в Гамбии, было предотвращено 37 процентов радиологической пневмонии, что отражает количество заболеваний, вызванных S.pneumoniae, , а смертность снизилась на 16 процентов (Cutts and others 2005).
Колонизация верхних дыхательных путей потенциально патогенными организмами и аспирация зараженных секретов участвуют в патогенезе бактериальной пневмонии у детей младшего возраста. Было показано, что инфицирование верхних дыхательных путей вирусом гриппа или RSV увеличивает связывание как H. influenzae (Jiang и др., 1999), так и S. pneumoniae (Hament and others 2004; McCullers and Bartmess 2003) с подкладкой. клетки носоглотки.Это открытие может объяснить, почему рост пневмококковой пневмонии идет параллельно с эпидемиями гриппа и RSV. Исследование, проведенное в Южной Африке, показало, что вакцинация девятивалентной пневмококковой конъюгированной вакциной снижает заболеваемость вирус-ассоциированной пневмонией, вызывающей госпитализацию, на 31 процент, что свидетельствует о том, что пневмококк играет важную роль в патогенезе вирус-ассоциированной пневмонии (Madhi, Petersen, Мадхи, Васас и др. 2000).
Попадание бактерий из кишечника с распространением через кровоток в легкие также было предложено для патогенеза грамотрицательных организмов (Fiddian-Green and Baker 1991), но такие бактерии являются необычными этиологическими агентами пневмонии у иммунокомпетентных дети.Однако у новорожденных и младенцев грудного возраста грамотрицательная пневмония не редкость (Quiambao готовится к печати).
Вирусы ответственны за от 40 до 50 процентов инфекций у младенцев и детей, госпитализированных по поводу пневмонии в развивающихся странах (Hortal and others 1990; John and others 1991; Tupasi and others 1990). Вирус кори, RSV, вирусы парагриппа, вирус гриппа типа A и аденовирусы являются наиболее важными причинами вирусной пневмонии. Рентгенологически сложно отличить вирусную пневмонию от бактериальной, отчасти потому, что поражения выглядят одинаково, а отчасти потому, что бактериальная суперинфекция возникает при гриппе, кори и инфекциях RSV (Ghafoor и др., 1990).
В развивающихся странах уровень летальности среди детей с вирусной пневмонией колеблется от 1,0 до 7,3 процента (John and others 1991; Stensballe, Devasundaram, and Simoes 2003), с бактериальной пневмонией от 10 до 14 процентов и со смешанной вирусной и вирусной пневмонией. бактериальные инфекции от 16 до 18 процентов (Ghafoor и др., 1990; Shann, 1986).
Бронхиолит
Бронхиолит возникает преимущественно в первый год жизни и с уменьшающейся частотой во второй и третий годы.Клинические признаки включают учащенное дыхание и втягивание нижней грудной стенки, лихорадку в одной трети случаев и хрипы (Cherian и др., 1990). Воспалительная обструкция мелких дыхательных путей, которая приводит к гиперинфляции легких и коллапсу сегментов легкого. Поскольку признаки и симптомы также характерны для пневмонии, работникам здравоохранения может быть сложно провести различие между бронхиолитом и пневмонией. Две особенности, которые могут помочь, — это определение сезонности RSV в данной местности и умение обнаруживать хрипы.RSV являются основной причиной бронхиолита во всем мире и могут вызывать до 70 или 80 процентов LRI в высокий сезон (Simoes 1999; Stensballe, Devasundaram и Simoes 2003). Недавно обнаруженный метапневмовирус человека также вызывает бронхиолит (Van den Hoogen и др., 2001), который неотличим от болезни RSV. Другие вирусы, вызывающие бронхиолит, включают вирус парагриппа 3-го типа и вирусы гриппа.
Грипп
Несмотря на то, что вирусы гриппа обычно вызывают инфекционные заболевания дыхательных путей у взрослых, они все чаще рассматриваются как важная причина инфекционных заболеваний кишечника у детей и, возможно, вторая по значимости причина госпитализации детей с ОРВ после RSV (Neuzil and others 2002). .Хотя грипп считается нечастым в развивающихся странах, его эпидемиология еще требует тщательного изучения. Потенциальное бремя гриппа как причина смерти детей неизвестно. Вирус гриппа типа A может вызывать сезонные вспышки, а тип B может вызывать спорадические инфекции. В последнее время вирус птичьего гриппа стал причиной инфекции, болезней и смерти небольшого числа людей, включая детей, в нескольких азиатских странах. Его потенциал для возникновения вспышек среди людей или пандемии неизвестен, но он может иметь разрушительные последствия для развивающихся стран (Peiris and others 2004) и может представлять угрозу для здоровья во всем мире.Новые штаммы вирусов типа А почти наверняка возникнут в результате мутации, как это произошло в случае пандемий в Азии и Гонконге в 1950-х и 1960-х годах.
ВИЧ-инфекция и педиатрические LRIs
Во всем мире 3,2 миллиона детей живут с ВИЧ / СПИДом, 85 процентов из них — в странах Африки к югу от Сахары (ЮНЭЙДС, 2002). В южной части Африки инфекционные заболевания, связанные с ВИЧ, составляют от 30 до 40 процентов случаев госпитализации детей и имеют показатель летальности от 15 до 34 процентов, что намного выше, чем 5-10 процентов для детей, не инфицированных ВИЧ (Bobat and others 1999; Мадхи, Петерсен, Мадхи, Хосал и другие, 2000; Натху и другие, 1993; Цви, Петтифиор и Содерлунд, 1999). Pneumocystis jiroveci и цитомегаловирус являются важными условно-патогенными инфекциями более чем у 50 процентов ВИЧ-инфицированных младенцев (Jeena, Coovadia, and Chrystal 1996; Lucas and others 1996). Грамотрицательные бактерии также важны для более чем 70 процентов ВИЧ-инфицированных детей с недостаточным питанием (Ikeogu, Wolf, and Mathe, 1997). Исследования пациентов подтвердили частую ассоциацию этих бактерий, но добавили S. pneumoniae и S. aureus в качестве важных патогенов (Gilks 1993; Goel and others 1999).В первом южноафриканском отчете об общем бремени инвазивной пневмококковой инфекции сообщается о 41,7-кратном увеличении числа ВИЧ-инфицированных детей по сравнению с неинфицированными детьми (Фарли и др., 1994).
Вмешательства
Вмешательства по борьбе с ОРИ можно разделить на четыре основные категории: иммунизация против конкретных патогенов, ранняя диагностика и лечение заболеваний, улучшение питания и более безопасная среда (John 1994). Первые два относятся к сфере компетенции системы здравоохранения, тогда как последние два относятся к сфере общественного здравоохранения и требуют многосекторального участия.
Прививки
Широкое использование вакцин против кори, дифтерии, коклюша, Hib, пневмококка и гриппа может существенно снизить заболеваемость ОРИ у детей в развивающихся странах. Влияние вакцин против кори, дифтерии и коклюша обсуждается в главе 20. Ограниченные данные о гриппе в развивающихся странах не позволяют провести подробный анализ потенциальных преимуществ этой вакцины. Поэтому в этой главе основное внимание уделяется потенциальному воздействию вакцин против Hib и пневмококка на LRI.
Вакцина против Hib
В настоящее время доступны три конъюгированные вакцины против Hib для применения у младенцев и детей младшего возраста. Эффективность вакцины против Hib в предотвращении инвазивных заболеваний (в основном менингита, но также и пневмонии) была хорошо задокументирована в нескольких исследованиях, проведенных в промышленно развитых странах (Black and others 1992; Booy and others 1994; Eskola and others 1990; Fritzell and Plotkin 1992; Heath 1998; Lagos and others 1996; Santosham and others 1991) и в одном исследовании в Гамбии (Mulholland and others 1997).Все исследования показали защитную эффективность более 90% против лабораторно подтвержденных инвазивных заболеваний, независимо от выбора вакцины. Следовательно, все промышленно развитые страны включают вакцину против Hib в свои национальные программы иммунизации, что приводит к фактической ликвидации инвазивной болезни Hib из-за иммунитета у вакцинированных и эффекта стада у тех, кто не вакцинирован. Имеющиеся данные из нескольких развивающихся стран показывают аналогичный эффект стада (Адегбола и др., 1999; Венгер и др., 1999).
Первоначальное обещание и последующее общее мнение заключалось в том, что вакцина против Hib предназначена для защиты от менингита, но в развивающихся странах вакцина, вероятно, будет иметь больший эффект в предотвращении LRI. Эффект легко измерить при инвазивных заболеваниях, включая бактериемическую пневмонию. Вакцина, вероятно, оказывает влияние на небактериемическую пневмонию, но этот эффект трудно определить количественно из-за отсутствия адекватного метода установления бактериальной этиологии. В Бангладеш, Бразилии, Чили и Гамбии вакцина против Hib была связана с уменьшением на 20-30 процентов числа госпитализированных с рентгенологически подтвержденной пневмонией (de Andrade and others 2004; Levine and others 1999; Mulholland and others 1997; WHO 2004a ).Однако результаты большого исследования в Ломбоке, Индонезия, не дали окончательных результатов в отношении влияния вакцины против Hib на пневмонию (Gessner and others 2005).
Пневмококковые вакцины
В настоящее время доступны два вида вакцин против пневмококков: 23-валентная полисахаридная вакцина (23-PSV), которая больше подходит для взрослых, чем для детей, и 7-валентная полисахаридная вакцина, конъюгированная с белком (7- PCV). 9-валентная вакцина (9-PCV) прошла клинические испытания в Гамбии и Южной Африке, а 11-валентная вакцина (11-PCV) проходит испытания на Филиппинах.
Исследования эффективности полисахаридной вакцины в профилактике ОРИ или ушных инфекций у детей в промышленно развитых странах показали противоречивые результаты. В то время как некоторые исследования этой вакцины не показывают значительной эффективности (Douglas and Miles 1984; Sloyer, Ploussard and Howie 1981), исследования из Финляндии показывают в целом защитный эффект против серотипов, содержащихся в 14-PSV (Douglas and Miles 1984; Karma and другие 1980; Макела и другие 1980). Эффективность была более выражена у детей старше двух лет, чем у детей младшего возраста.Единственные исследования, оценивающие действие полисахаридной вакцины на детей в развивающихся странах, — это серия из трех испытаний, проведенных в Папуа-Новой Гвинее (Douglas and Miles 1984; Lehmann and others 1991; Riley and others 1981; Riley, Lehmann, and Alpers 1991). . Анализ объединенных данных этих испытаний показал снижение смертности от LRI на 59 процентов среди детей до пяти лет на момент вакцинации и на 50 процентов среди детей до двух лет. На основании этих и других исследований исследователи пришли к выводу, что вакцина оказывает влияние на тяжелую пневмонию.Более высокая, чем ожидалось, эффективность в этих испытаниях была приписана большему вкладу более иммуногенных серотипов взрослых в пневмонию в Папуа-Новой Гвинее (Douglas and Miles 1984; Riley, Lehmann, and Alpers 1991). Из-за низкой иммуногенности антигенов в 23-PSV против преобладающих детских серотипов внимание теперь направлено на более иммуногенные конъюгированные вакцины (Mulholland 1998; Obaro 1998; Temple 1991).
Эффективность 7-PCV и 9-PCV была оценена на предмет эффективности против инвазивного пневмококкового заболевания в четырех испытаниях, которые продемонстрировали эффективность вакцины от 71.От 0 до 97,4 процента (от 58 до 65 процентов для ВИЧ-положительных детей, среди которых заболеваемость пневмококком в 40 раз выше, чем среди ВИЧ-отрицательных детей) (Black and others 2000; Cutts and others 2005; Klugman and others 2003; O ‘ Брайен и другие 2003).
В США 7-PCV был включен в плановую вакцинацию младенцев и детей в возрасте до двух лет в 2000 году. К 2001 году заболеваемость всеми инвазивными пневмококковыми заболеваниями в этой возрастной группе снизилась на 69 процентов, а заболевания, вызываемые включенными серотипами вакцины и родственных серотипов снизились на 78 процентов (Whitney and others 2003).Подобные сокращения были подтверждены в исследовании в северной Калифорнии (Black and others 2001). Наблюдалось небольшое увеличение частоты инвазивных заболеваний, вызванных серотипами пневмококков, не включенных в вакцину, но оно было недостаточно большим, чтобы компенсировать существенное снижение заболеваемости, вызванное вакциной. Исследования также обнаружили значительное снижение инвазивной пневмококковой инфекции в непривитых старших возрастных группах, особенно среди взрослых в возрасте от 20 до 39 лет и в возрасте 65 лет и старше, что позволяет предположить, что вакцинация маленьких детей оказала значительный эффект в обществе.Такое преимущество может иметь место даже там, где распространенность ВИЧ-инфекции среди взрослых высока, а пневмококковая инфекция может быть рецидивирующей и опасной для жизни.
Воздействие вакцины на пневмококковую пневмонию как таковое трудно определить из-за проблем, связанных с установлением бактериальной этиологии пневмонии. В трех исследованиях оценивали влияние вакцины на рентгенологическую пневмонию (независимо от этиологического агента) и показали снижение на 20,5-37,0% случаев пневмонии, подтвержденной рентгенологически (9.0 процентов для ВИЧ-инфицированных) (Black and others 2000; Cutts and others 2005; Klugman and others 2003).
Несколько полевых испытаний оценили эффективность PCV против ушной инфекции. Несмотря на то, что вакцина привела к значительному сокращению подтвержденного посевом пневмококка отита, чистого снижения ушной инфекции среди вакцинированных детей не наблюдалось, вероятно, из-за увеличения частоты отита, вызванного видами пневмококков, не охваченных вакциной, ЧАС.influenzae и Moraxella catarrhalis (Eskola and others 2001; Kilpi and others 2003). Однако испытание в северной Калифорнии показало, что вакцина обладает защитным действием против частых инфекций уха и снижает потребность в установке тимпаностомической трубки (Fireman and others 2003). Таким образом, вакцина от ушной инфекции может быть полезной в развивающихся странах с высокими показателями хронического отита и кондуктивной тугоухости, и ее следует оценивать с помощью клинических испытаний.
Самым заметным преимуществом вакцины для общественного здравоохранения в развивающихся странах будет очевидное снижение смертности.Хотя первичным результатом исследования в Гамбии изначально была детская смертность, она была изменена на радиологическую пневмонию. Тем не менее, испытание показало снижение смертности на 16 процентов (уровень достоверности 95 процентов, от 3 до 38). Это испытание проводилось в сельской местности на востоке Гамбии, где трудно обеспечить круглосуточную лечебную помощь, включая ведение больных. Это испытание демонстрирует, что иммунизация, проводимая в рамках аутрич-программ, принесет значительную пользу для здоровья и экономики таких групп населения.Еще одно исследование, оценивающее влияние 11-PCV на радиологическую пневмонию, продолжается на Филиппинах; результаты ожидаются во второй половине 2005 года.
Ведение пациентов
Упрощение и систематизация ведения пациентов для ранней диагностики и лечения ОРИ позволили значительно снизить смертность в развивающихся странах, где доступ к педиатрам ограничен. В клинических рекомендациях ВОЗ по ведению случаев ОРИ (ВОЗ, 1991) используются два ключевых клинических признака: частота дыхания, , чтобы отличить детей с пневмонией от детей без, и втягивание нижней грудной стенки, , чтобы определить тяжелую пневмонию, требующую направления и госпитализации.Детям со слышимым стридором в спокойном и спокойном состоянии или такими опасными признаками тяжелого заболевания, как неспособность есть, также требуется направление. Дети без этих признаков классифицируются как страдающие ОРИ, но не пневмонией. Детей, у которых наблюдается только учащенное дыхание, лечат пневмонию амбулаторно. Детей, которые кашляют более 30 дней, направляют для дальнейшего обследования на туберкулез и другие хронические инфекции.
Диагностика пневмонии на основе учащенного дыхания
Первоначальные рекомендации по выявлению пневмонии на основе учащенного дыхания были разработаны в Папуа-Новой Гвинее в 1970-х годах.В исследовании 200 последовательных педиатрических пациентов и 50 последовательных госпитализаций (Shann, Hart, and Thomas 1984) 72 процента детей со слышимым хрипом в легких имели частоту дыхания 50 или более вдохов в минуту, тогда как только 19 процентов детей без потрескивания дышал с такой стремительной скоростью. Поэтому в первоначальных рекомендациях ВОЗ использовался порог в 50 вдохов в минуту, при достижении которого кашель у ребенка считался пневмонией.
Основное беспокойство вызывает относительно низкая чувствительность этого подхода, который может упустить от 25 до 40 процентов случаев пневмонии.Исследование в Веллоре, Индия, показало, что чувствительность можно улучшить, снизив порог до 40 для детей в возрасте от 1 до 4 лет, сохранив порог в 50 вдохов в минуту для младенцев в возрасте от 2 до 11 месяцев (Cherian and others 1988). Последующие исследования показали, что при использовании этих пороговых значений чувствительность улучшилась с 62 до 79 процентов на Филиппинах и с 65 до 77 процентов в Свазиленде, но в то же время специфичность упала с 92 до 77 процентов на Филиппинах и с 92 до 80 процентов. процентов в Свазиленде (Mulholland и др., 1992).На основе этих и других данных (Кэмпбелл, Байасс и др., 1989; Колстад и др., 1997; Перкинс и др., 1997; Редд, 1994; Симоес и др., 1997; Вебер и др., 1997) ВОЗ рекомендует ограничить частоту дыхания на 50 вдохов. в минуту для детей в возрасте от 2 до 11 месяцев и 40 вдохов в минуту для детей в возрасте от 12 месяцев до 5 лет.
Учащенное дыхание, по определению ВОЗ, выявляет около 85 процентов детей с пневмонией, и более 80 процентов детей с потенциально смертельной пневмонией, вероятно, успешно выявляются и лечатся с использованием диагностических критериев ВОЗ.Было показано, что лечение детей с учащенным дыханием антибиотиками снижает смертность (Sazawal and Black 2003). Проблема низкой специфичности критерия учащенного дыхания заключается в том, что от 70 до 80 процентов детей, которые могут не нуждаться в антибиотиках, получат их. Тем не менее, для работников первичной медико-санитарной помощи, для которых важна простота диагностики, учащенное дыхание, несомненно, является наиболее полезным клиническим признаком.
Диагноз пневмонии на основании втягивания грудной стенки
Дети поступают в больницу с тяжелой пневмонией, когда медицинские работники считают, что необходимы кислородные или парентеральные антибиотики (антибиотики, вводимые не перорально), или когда они не уверены в способности матери справиться .Обоснование парентеральных антибиотиков состоит в том, чтобы достичь более высоких уровней антибиотиков и преодолеть опасения по поводу абсорбции пероральных препаратов у больных детей.
В исследовании Папуа-Новой Гвинеи (Shann, Hart, and Thomas 1984) втягивание грудной клетки использовалось в качестве основного показателя тяжести, но исследования, проведенные в разных частях мира, показывают большие различия в темпах втягивания из-за различных определений. Ограничение этого термина втягиванием нижней грудной стенки, определяемым как движение внутрь костных структур грудной стенки с вдохом, предоставило лучший индикатор тяжести пневмонии, который можно научить медработникам.Он более специфичен, чем втяжение межреберных промежутков, которое часто встречается при бронхиолите.
В исследовании, проведенном в Гамбии (Кэмпбелл, Байасс и др., 1989), когорта из 500 детей от рождения до четырех лет посещалась дома еженедельно в течение одного года. За это время в клинику было направлено 222 эпизода LRI (учащенное дыхание, любое втягивание грудной стенки, расширение носа, свистящее дыхание, стридор или признаки опасности). Втяжение грудной клетки имело место в 62 процентах этих случаев, во многих случаях втягивание межреберных мышц.Если бы всех детей с каким-либо втягиванием грудной клетки госпитализировали, их количество превысило бы количество детских стационаров.
Исследования, проведенные на Филиппинах и в Свазиленде (Mulholland и др., 1992), показали, что втягивание нижней грудной стенки было более специфичным, чем втягивание межреберья, для диагностики тяжелой пневмонии, требующей госпитализации. В исследовании Веллора (Cherian and others 1988) втягивание нижней грудной стенки правильно предсказало 79 процентов детей с LRI, которые были госпитализированы педиатром.
Варианты противомикробных препаратов для перорального лечения пневмонии
Выбор противомикробного препарата для лечения основан на хорошо известных данных о том, что большинство бактериальных пневмоний у детей вызывается S. pneumoniae или H. influenzae . Однократная инъекция бензатин-пенициллина, хотя и длится долго, не обеспечивает адекватных уровней пенициллина для уничтожения H. influenzae . У ВОЗ есть технические документы, помогающие оценить соответствующие факторы при выборе противомикробных препаратов первого и второго ряда и сравнения различных противомикробных препаратов в отношении их антибактериальной активности, эффективности лечения и токсичности (ВОЗ, 1990).
Возникновение устойчивости к противомикробным препаратам у S. pneumoniae и H. influenzae вызывает серьезную озабоченность. В некоторых условиях тесты in vitro показывают, что более 50 процентов респираторных изолятов обеих бактерий устойчивы к ко-тримоксазолу, а устойчивость к пенициллину к S. pneumoniae постепенно становится проблемой во всем мире.
При пневмонии, в отличие от менингита, устойчивость возбудителя in vitro не всегда приводит к неэффективности лечения.Сообщения из Испании и Южной Африки предполагают, что пневмонию, вызванную устойчивым к пенициллину S. pneumoniae , можно успешно лечить с помощью достаточно высоких доз пенициллина. Амоксициллин концентрируется в тканях и макрофагах, и уровни препарата напрямую зависят от пероральных дозировок. Поэтому для успешного лечения ушных инфекций, вызванных устойчивым к пенициллину S. pneumoniae , в настоящее время используются более высокие дозы, чем в прошлом, — назначаемые дважды в день. Амоксициллин явно лучше пенициллина при таких инфекциях.Ситуация с ко-тримоксазолом менее ясна (Strauss and others 1998), и перед лицом высоких показателей устойчивости к ко-тримоксазолу амоксициллин может быть лучше для детей с тяжелой пневмонией.
Внутримышечные антибиотики для лечения тяжелой пневмонии
Несмотря на то, что хлорамфеникол активен против S. pneumoniae и H. influenzae, его пероральное всасывание у чрезвычайно больных детей нестабильно. Таким образом, рекомендации ВОЗ рекомендуют вводить хлорамфеникол внутримышечно в половине суточной дозы до срочного направления пациентов с тяжелой пневмонией.Дополнительным объяснением является то, что у крайне больных детей может быть сепсис или менингит, которые трудно исключить, и их необходимо немедленно лечить. Хотя внутривенный хлорамфеникол превосходит внутримышечный хлорамфеникол, процедура может отсрочить срочно необходимое лечение и увеличивает его стоимость.
Исследователи поставили под сомнение адекватность и безопасность внутримышечного хлорамфеникола. Хотя ранние исследования показали, что уровни взрослого в крови после внутримышечного введения были значительно ниже, чем после внутривенного введения, внутримышечный путь введения получил широкое признание после клинических отчетов, которые подтвердили его эффективность.Местные осложнения при внутримышечном введении сукцината левомицетина возникают редко, в отличие от более ранних внутримышечных препаратов. Хотя беспокойство по поводу апластической анемии после приема хлорамфеникола является обычным явлением, это осложнение крайне редко встречается у маленьких детей. Нет никаких доказательств того, что сукцинат хлорамфеникола внутримышечно вызывает побочные эффекты с большей вероятностью, чем другие формы и пути введения хлорамфеникола.
Диагностика гипоксемии на основе критериев ВОЗ
Стратегии ведения случаев ОРИ и комплексного ведения болезней грудного и детского возраста (ИВБДВ) зависят от точного направления больных детей в больницу и правильного стационарного лечения ИРН с применением кислорода или антибиотиков.Гипоксемия (дефицит кислорода в крови) у детей с LRI является хорошим предиктором смертности, коэффициент летальности в 1,2-4,6 раза выше при гипоксемическом LRI, чем при негипоксемическом LRI (Duke, Mgone, and Frank 2001; Onyango and others 1993). ), а кислород снижает смертность. Таким образом, важно как можно раньше выявлять гипоксемию у детей с LRI, чтобы предотвратить смерть. Хотя диагноз острой LRIs очень легко устанавливается путем распознавания тахипноэ, и хотя тяжелая LRI связана с втягиванием грудной стенки, клиническое распознавание гипоксемии более проблематично.Были изучены различные наборы клинических правил для прогнозирования наличия гипоксемии у детей с LRI (Cherian и др., 1988; Onyango и др., 1993; Usen и др., 1999). Хотя некоторые клинические инструменты обладают высокой чувствительностью для выявления гипоксемии, большое количество детей с гипоксемией все же будет пропущено при использовании этих критериев. Пульсоксиметрия — лучший инструмент для быстрого выявления гипоксемии у больных детей. Однако пульсоксиметры дороги и требуют периодических затрат на замену датчиков, по которым они недоступны в большинстве районных или даже специализированных больниц в развивающихся странах.
Руководство по лечению
Текущие рекомендации включают прием ко-тримоксазола два раза в день в течение пяти дней при пневмонии и внутримышечный пенициллин или хлорамфеникол для детей с тяжелой пневмонией. Проблемы повышения устойчивости к ко-тримоксазолу и ненужные направления детей с втягиванием грудной стенки привели к исследованиям, в которых изучаются альтернативы антибиотикам, которые в настоящее время используются при лечении ОРИ. Одно исследование показало, что амоксициллин и котримоксазол одинаково эффективны при нетяжелой пневмонии (Catchup Study Group 2002), хотя амоксициллин стоит в два раза дороже, чем котримоксазол.Что касается продолжительности лечения антибиотиками, исследования в Бангладеш, Индии и Индонезии показывают, что трехдневный пероральный прием котримоксазола или амоксициллина так же эффективен, как пять дней приема любого из препаратов у детей с нетяжелой пневмонией (Agarwal and others 2004; Kartasasmita 2003). ). В многоцентровом исследовании пенициллина, вводимого внутримышечно, и перорального амоксициллина у детей с тяжелой пневмонией, Аддо-Йобо и другие (2004) обнаружили схожие показатели излечения. Поскольку пациенты получали кислород при необходимости от гипоксемии и были переведены на другие антибиотики в случае неудачи, этот режим не подходит для лечения тяжелой пневмонии в амбулаторных условиях.
ВОЗ рекомендует назначать кислород, если он имеется в достаточном количестве, детям с признаками и симптомами тяжелой пневмонии и, если подача ограничена, детям с любым из следующих признаков: неспособность есть и пить, цианоз, частота дыхания выше или равный 70 вдохам в минуту, или серьезное втягивание грудной стенки (ВОЗ, 1993). Кислород следует вводить со скоростью 0,5 литра в минуту для детей младше 2 месяцев и 1 литр в минуту для детей старшего возраста. Поскольку кислород стоит дорого и его не хватает, особенно в отдаленных сельских районах развивающихся стран, ВОЗ рекомендует простые клинические признаки для выявления и лечения гипоксемии.Несмотря на эти рекомендации, исследование 21 учреждения первого уровня и районной больницы в семи развивающихся странах показало, что более 50 процентов госпитализированных детей с LRI неправильно лечились антибиотиками или кислородом (Nolan and others 2001), а в некоторых случаях кислород был недостаточным. в дефиците. Очевидно, что обеспечение кислородом младенцев с гипоксемией спасает жизнь, хотя никаких рандомизированных испытаний, подтверждающих это, не проводилось.
Профилактика и лечение пневмонии у ВИЧ-позитивных детей
Текущие рекомендации группы ВОЗ по ведению пневмонии у ВИЧ-позитивных детей и профилактике Pneumocystis jiroveci следующие (ВОЗ 2003):
Нетяжелая пневмония в возрасте до 5 лет. Пероральный котримоксазол должен оставаться антибиотиком первой линии, но следует использовать пероральный амоксициллин, если он доступен по цене или если ребенок проходил профилактику котримоксазолом.
Тяжелая или очень тяжелая пневмония. Нормальные руководящие принципы ВОЗ по ведению больных следует использовать для детей в возрасте до 2 месяцев. Детям от 2 до 11 месяцев рекомендуются инъекционные антибиотики и лечение пневмонии Pneumocystis jiroveci , а также начинается профилактика пневмонии Pneumocystis jiroveci после выздоровления.Для детей в возрасте от 12 до 59 месяцев лечение состоит из инъекционных антибиотиков и терапии пневмонии Pneumocystis jiroveci . Pneumocystis jiroveci Профилактика пневмонии должна проводиться в течение 15 месяцев детям, рожденным от ВИЧ-инфицированных матерей; однако эта рекомендация редко выполнялась.
Рентабельность вмешательств
Пневмония является причиной примерно пятой части из примерно 10,6 миллиона случаев смерти детей в возрасте до пяти лет в год.Там, где первичная медико-санитарная помощь является слабой, сокращение смертности с помощью мер общественного здравоохранения является приоритетной задачей. Как отмечалось ранее, доступные вмешательства — это первичная профилактика путем вакцинации и вторичная профилактика путем раннего выявления и ведения случаев заболевания.
Рентабельность вакцин против Hib обсуждается в главе 20. Мы не пытались анализировать рентабельность пневмококковых вакцин, потому что глобальные и региональные оценки бремени пневмококковой пневмонии в настоящее время разрабатываются и будут доступны только после позже в 2005 году.Кроме того, текущие цены на вакцины относительно стабильны в развитых странах, но ожидается, что цены для стран с низким и средним уровнем доходов будут значительно ниже, если вакцины закупаются на глобальном тендере.
Мы оцениваем стратегии вмешательства по ведению случаев LRIs у детей в возрасте до пяти лет. Медицинские работники, которые внедряют ведение пациентов, диагностируют LRI на основании учащенного дыхания, втягивания нижней грудной стенки или отдельных признаков опасности у детей с респираторными симптомами.Поскольку этот метод не делает различий между пневмонией и бронхиолитом, а также между бактериальной и вирусной пневмонией, мы группируем эти состояния в общую категорию «клиническая пневмония» (Rudan and others 2004). Этот подход предполагает, что большая часть клинической пневмонии имеет бактериальное происхождение и что медицинские работники могут значительно снизить летальность посредством диагностики частоты дыхания и своевременного приема антибиотиков (Sazawal and Black 2003). Мы рассчитали затраты на лечение по регионам Всемирного банка, используя стандартизованные исходные затраты, предоставленные редакторами томов, и затраты, опубликованные в Международном справочнике по индикаторам цен на лекарства (Management Sciences for Health 2005) и другой литературе ().В анализе рассматриваются четыре категории ведения больных, которые различаются тяжестью инфекции и точкой лечения:
Таблица 25.1
Входные данные для ведения случаев пневмонии в странах с низким и средним уровнем доходов.
нетяжелая пневмония, лечение в больнице
нетяжелая пневмония, лечение в медицинском учреждении
тяжелая пневмония, лечение в больнице
очень тяжелая пневмония, лечение в больнице.
Информация об этих категориях ведения пациентов и их результатах взята из отчета о методологии и предположениях, использованных для оценки затрат на расширение масштабов отдельных медицинских вмешательств, направленных на детей (ВОЗ и Здоровье детей-подростков, готовится к печати). Мы предположили, что для каждого пациента, которого лечит местный медицинский работник, в общей сложности будет три контрольных визита, а не повторные осмотры два раза в день в течение 10 дней, рекомендованные в отчете. Мы также предположили, что все пациенты с тяжелой пневмонией проходят рентгенологическое обследование, а не только 20 процентов, как это предлагается в отчете.Более того, мы приняли пятичасовой рабочий день для общинного медработника, минимальный рабочий день, необходимый для общинных медицинских работников в рамках инициативы «Здоровье и выживание детей» Агентства США по международному развитию (Bhattacharyya and others 2001).
представляет региональные оценки средних затрат на лечение на эпизод для четырех стратегий ведения случая. Поскольку мы считали, что цены на торгуемые товары, такие как лекарства и кислород, постоянны в разных регионах, региональные различия были вызваны различиями в расходах на больницы и медицинских работников.Латинская Америка и Карибский бассейн, Ближний Восток и Северная Африка имели самые высокие затраты на лечение.
Таблица 25.2
Средние затраты на лечение за один эпизод вмешательств по ведению пациентов с острой респираторной инфекцией нижних дыхательных путей (2001 долл. США).
Мы рассчитали региональные коэффициенты экономической эффективности (ССВ) для модельной численности населения в 1 миллион человек в каждом регионе, следуя стандартизированным руководящим принципам для экономического анализа (подробности см. В главе 15). Входные переменные включали стоимость лечения, подробно описанную в и, региональные показатели заболеваемости LRI, адаптированные из материалов Рудана и других (готовится к публикации), региональные показатели смертности и возрастные структуры, предоставленные редакторами томов, а также соотношение городского и сельского населения по регионам (World Банк 2002).Регион Европы и Центральной Азии был исключен из этого анализа из-за отсутствия информации о заболеваемости. В связи с отсутствием информации по регионам, мы предположили, что уровни эффективности вмешательства будут одинаковыми.
Количество лет жизни с поправкой на инвалидность можно предотвратить за счет сокращения продолжительности болезни и снижения смертности с помощью лечения. Мы предположили, что средняя продолжительность болезни составляет 8,5 дней для тех, кто не лечился, и 6,0 дней для тех, кто лечился. Мы использовали снижение летальности на 36,0% за счет лечения (Sazawal and Black 2003) и специфичность диагноза 78.5 процентов для пациентов, которым поставлен диагноз только на основании частоты дыхания. Вес нетрудоспособности одновременно с инфекцией составил 0,28. Мы не рассматривали инвалидность, вызванную хроническими последствиями LRI, потому что неясно, вызывает ли LRI в детстве долгосрочное нарушение функции легких или дети, у которых развивается нарушение функции легких, более склонны к инфекции (von Mutius 2001).
Поскольку один год этих вмешательств дает только одновременные выгоды — поскольку эффективно пролеченные люди не обязательно доживают до ожидаемой продолжительности жизни, учитывая, что они, вероятно, снова заразятся в следующем году, — мы рассчитали рентабельность пятилетнего вмешательства .Этот период времени позволил нам рассмотреть случай, когда целая когорта новорожденных и детей в возрасте от четырех лет избежала смертности от клинической пневмонии в раннем детстве благодаря вмешательству и получила преимущество, дожившее до ожидаемой продолжительности жизни. Наконец, в этом анализе учитывались только долгосрочные предельные затраты, которые варьируются в зависимости от количества пациентов, прошедших лечение, и не учитывались постоянные затраты на запуск программы, которых в настоящее время не существует.
представляет ССВ для конкретных регионов четырех категорий ведения случаев, а также ССВ для предоставления всех четырех категорий населению в 1 миллион человек.Во всех странах с низким и средним уровнем доходов лечение нетяжелой клинической пневмонии было более рентабельным на уровне учреждения, чем на уровне общины, и из всех четырех категорий ведения случая лечение очень тяжелой клинической пневмонии на уровне больниц было более эффективным. наименее рентабельный. Лечение нетяжелой клинической пневмонии на уровне учреждения было более рентабельным, чем лечение общинным работником здравоохранения, из-за более низкой стоимости одного посещения медицинского учреждения, чем многократных посещений медицинского работника.CER предоставления всех уровней лечения для всех стран с низким и средним уровнем доходов оценивается в 398 долларов США на год жизни с поправкой на инвалидность.
Таблица 25.3
ССВ вмешательств по ведению пациентов с пневмонией (2001 долл. США / год жизни с поправкой на инвалидность).
Поскольку мы предположили, что показатели эффективности были постоянными, региональные различия в CER для каждой категории ведения случая были связаны только с вариациями затрат на вмешательство, а относительные рейтинги экономической эффективности для стратегий были одинаковыми для всех регионов.Различия в ССВ для оказания всех категорий медицинской помощи также были обусловлены региональным соотношением городского и сельского населения. Мы предположили, что все пациенты в городских районах обращаются за лечением на уровне учреждения или выше, тогда как 80 процентов нетяжелых пациентов в сельской местности получают лечение на уровне сообщества, а остальные обращаются за лечением на уровне учреждения.
Внедрение стратегий борьбы с ОРИ: уроки опыта
Уроки стратегий профилактики и контроля ОРИ, реализованные в рамках национальных программ, включают стратегии вакцинации и ведения больных, описанные ниже.
Вакцины. Стратегии
Вакцина против Hib была включена в календарь плановой иммунизации младенцев в Северной Америке и Западной Европе в начале 1990-х годов. С созданием Глобального альянса по вакцинам и иммунизации (ГАВИ) и Фонда вакцин был достигнут прогресс в их внедрении в развивающихся странах, хотя серьезные препятствия остаются. К 2002 г. только 84 из 193 стран-членов ВОЗ ввели вакцину против Hib. С тех пор пять стран получили одобрение ГАВИ на поддержку внедрения вакцины против Hib в 2004–2005 годах.
Соединенные Штаты добавили 7-PCV в программу иммунизации младенцев в 2000 году. Некоторые другие промышленно развитые страны планируют включить вакцину в свои национальные программы иммунизации в 2005 году, тогда как другие рекомендуют использовать вакцину только в отдельных группах высокого риска. . В некоторых из этих последних стран определение высокого риска является довольно широким и включает значительную долю всех младенцев. В лицензированном в настоящее время 7-PCV отсутствуют определенные серотипы, важные для развивающихся стран, но 9-PCV и 11-PCV охватывают почти 80 процентов серотипов, вызывающих серьезные заболевания во всем мире.
Несмотря на успех вакцины против Hib в промышленно развитых странах и общепризнанное значение LRI как причины детской смертности, в результате действия ряда взаимосвязанных факторов внедрение вакцины в развивающихся странах было медленным. Устойчивое использование вакцины находится под угрозой в нескольких странах, которые ввели вакцину. Во-первых, масштабы заболеваний и смертей, вызванных Hib, не признаются в этих странах, отчасти из-за недостаточного использования бактериологической диагностики (в результате нехватки оборудования и ресурсов).Во-вторых, поскольку охват, достигнутый с помощью традиционных расширенных программ иммунизации вакцинами, остается низким во многих странах, добавление дополнительных вакцин не было определено в качестве приоритета. В-третьих, развивающиеся страны не предпринимали усилий по установлению полезности вакцины до тех пор, пока вакцина не была лицензирована и не использовалась регулярно в течение нескольких лет в промышленно развитых странах. Следовательно, вакцинация против Hib воспринималась как средство вмешательства для богатых стран. В результате всех этих факторов фактический спрос на вакцину оставался низким, даже когда поддержка предоставлялась через ГАВИ и Фонд вакцин.
В 2004 году правление ГАВИ поручило целевой группе по Hib изучить, как лучше всего поддержать национальные усилия по принятию основанных на фактических данных решений о внедрении вакцины против Hib. На основе рекомендаций целевой группы правление ГАВИ одобрило создание Инициативы против Hib для поддержки тех стран, которые желают либо продолжить вакцинацию против Hib, либо изучить вопрос о том, должно ли внедрение вакцины против Hib быть приоритетом для их систем здравоохранения. Консорциум, состоящий из Школы общественного здравоохранения Блумберга Джонса Хопкинса, Лондонской школы гигиены и тропической медицины, Центров по контролю и профилактике заболеваний и ВОЗ, был выбран для руководства этими усилиями.
Стратегии ведения случаев
Метаанализ исследований Сазавала и Блэка (Sazawal and Black, 2003) на уровне сообществ, посвященных стратегии ведения случаев ОРИ, включает 10 исследований, в которых оценивалось ее влияние на смертность, 7 с одновременной контрольной группой. Метаанализ показал снижение смертности от всех причин на 27 процентов среди новорожденных, на 20 процентов среди младенцев и на 24 процента среди детей в возрасте от одного до четырех лет. Смертность от LRI снизилась на 42, 36 и 36 процентов соответственно. Эти данные ясно показывают, что относительно упрощенное, но стандартизованное ведение случаев ОРИ может иметь значительное влияние на смертность не только от пневмонии, но и от других причин у детей от рождения до четырех лет.В настоящее время стратегия ведения пациентов с ОРИ включена в стратегию ИВБДВ, которая в настоящее время применяется более чем в 80 странах (см. Главу 63).
Несмотря на то, что каждый год из-за пневмонии гибнет огромное количество людей, обещания, заложенные в упрощенном ведении больных, не были успешно реализованы во всем мире. Одна из основных причин — недостаточное использование медицинских учреждений в странах или сообществах, в которых многие дети умирают от ОРИ. В Бангладеш, например, 92 процента больных детей не попадают в соответствующие медицинские учреждения (ВОЗ, 2002 г.).В Боливии 62 процента умерших детей не были доставлены к врачу в случае болезни (Aguilar and others 1998). В Гвинее 61 процент умерших больных детей не были доставлены к врачу (Schumacher and others 2002). Исследование Шелленберга и других (2003), проведенное в Танзании, показывает, что дети из более бедных семей реже получают антибиотики от пневмонии, чем дети из более обеспеченных семей, и что только 41 процент больных детей доставляют в медицинские учреждения.Таким образом, исследования неизменно подтверждают, что больные дети, особенно из бедных семей, не посещают медицинские учреждения.
Ряд стран разработали крупномасштабные и устойчивые программы лечения на уровне сообществ:
- В Гамбии действует национальная программа лечения пневмонии на уровне общин (ВОЗ 2004b).
- В районе Сиая в Кении неправительственная организация эффективно предоставляет медицинскими работниками лечение пневмонии и других детских болезней (ВОЗ, 2004b).
- В Гондурасе управление ОРИ было включено в Национальную интегрированную программу общинного ухода за детьми, в соответствии с которой добровольцы из местных сообществ проводят мониторинг роста, проводят санитарное просвещение и лечат пневмонию и диарею в более чем 1800 сообществах (ВОЗ 2004b).
В Бангладеш Комитет по развитию сельских районов Бангладеш и правительство внедрили программу борьбы с ОРИ, охватывающую 10 подокругов, с привлечением добровольцев из местных медицинских работников. Каждый работник отвечает за лечение детской пневмонии примерно в 100–120 домашних хозяйствах после трехдневной программы обучения.
- В Непале в 1986–89 гг. Общинная программа лечения ОРИ и диарейных заболеваний была протестирована в двух округах и показала существенное снижение смертности от LRI (Pandey and others 1989, 1991). В результате программа была интегрирована в службы здравоохранения Непала и реализуется в 17 из 75 округов страны женщинами-добровольцами, обученными выявлять и лечить пневмонию.
- В Пакистане в программе Lady Health Worker Program работает около 70 000 женщин, которые работают в общинах, обеспечивая образование и ведение детской пневмонии более чем 30 миллионам человек (ВОЗ 2004b).
Программа исследований и разработок
Программа исследований и разработок, изложенная ниже, суммирует приоритеты, установленные консультативными группами Инициативы по исследованиям вакцин (стратегии вмешательства в отношении вакцин) и Отдела ВОЗ по охране здоровья детей и подростков (случай — стратегии управления).
Стратегии вакцинации
Целевая группа ГАВИ по иммунизации против Hib дала ряд рекомендаций, которые различаются в зависимости от страны.Страны, внедрившие вакцину против Hib, должны сосредоточиться на документировании ее эффекта и должны использовать данные для информирования национальных органов власти, партнеров по развитию и других учреждений, занимающихся общественным здравоохранением, для обеспечения постоянной поддержки таких программ вакцинации. Страны, имеющие право на поддержку ГАВИ, которые еще не внедрили вакцины против Hib, часто сталкиваются с ограничениями из-за отсутствия местных данных и недостаточной осведомленности о региональных данных. Они могут решать эти вопросы на субрегиональных встречах, на которых страновые эксперты могут объединять данные и анализировать информацию из других стран.Кроме того, большинству стран необходимо проводить экономический анализ, основанный на стандартизированном инструменте. Наконец, всем странам, которые сталкиваются с высоким бременем Hib-инфекции, необходимо создать лабораторное оборудование, чтобы они могли определять заболеваемость Hib-менингитом в выбранных местах. Страны, в которых бремя болезни остается неясным, могут иметь ограниченные возможности для документирования случаев заболевания Hib с использованием протоколов, основанных на эпиднадзоре за инвазивным менингитом. Им необходимо будет изучить возможности использования альтернативных методов измерения бремени болезней, включая использование исследований вакцины.
Основываясь на опыте внедрения вакцин против Hib и гепатита B, ГАВИ проявил инициативу и в 2003 году на базе Школы общественного здравоохранения Джона Хопкинса в Балтиморе учредил инициативу по реализации программы ускоренной разработки и внедрения пневмококковых вакцин ( PneumoADIP; см. Http://www.preventpneumonia.org). Целью программы является установление и информирование о ценности пневмококковых вакцин и поддержка их доставки. Установление ценности вакцины требует разработки местных данных о бремени болезни и потенциальном воздействии вакцины на здоровье населения.Эти усилия могут быть достигнуты за счет усиленного эпиднадзора за болезнями и соответствующих клинических испытаний в выбранном количестве ведущих стран. После создания доказательная база будет передана лицам, принимающим решения, и ключевым лидерам общественного мнения, чтобы гарантировать принятие решений на основе данных. После того, как будет установлена рентабельность плановой вакцинации, необходимо будет создать системы доставки, и странам потребуется финансовая поддержка, чтобы вакцины могли быть включены в их программы иммунизации.Эти мероприятия инициируются до выпуска вакцин, предназначенных для использования в развивающихся странах, чтобы информировать о планировании потенциала, доступности продуктов и ценообразовании.
Стратегии ведения случаев
В 2003 г. Отдел здоровья детей и подростков ВОЗ созвал совещание для обзора данных и доказательств недавних исследований лечения ОРИ и предложения следующих изменений в руководящие принципы ведения случаев и приоритеты будущих исследований:
- Нетяжелая пневмония:
Повышение специфичности клинических диагностических критериев.
Пересмотреть текущие рекомендуемые ВОЗ критерии для выявления и лечения неудач лечения с учетом высоких показателей неудач терапии.
Проведите повторный анализ данных краткосрочных курсов терапии, чтобы лучше определить факторы, определяющие неэффективность лечения.
Провести плацебо-контролируемые испытания среди детей с хрипом и пневмонией в выбранных условиях с высокой распространенностью хрипов, чтобы определить, нуждаются ли такие дети в антибиотиках.
- Тяжелая пневмония. В рандомизированном клиническом исследовании в контролируемой среде Аддо-Йобо и другие (2004) показали, что пероральный амоксициллин так же эффективен, как парентеральный пенициллин или ампициллин; тем не менее, прежде чем его можно будет рекомендовать в целом, необходимо предпринять следующие действия:
Проанализировать данные об исключениях из исследования.
Определите предикторы, которые могут помочь отличить детей, нуждающихся в госпитализации и у которых впоследствии ухудшается состояние.
Переоценить текущие критерии неэффективности лечения, рекомендованные ВОЗ для тяжелой пневмонии, с учетом общих высоких показателей неэффективности терапии.
Провести описательные исследования в условиях общественного здравоохранения в нескольких центрах по всему миру, чтобы оценить клинические результаты перорального приема амоксициллина у детей в возрасте от 2 до 59 месяцев, у которых наблюдается втягивание нижней грудной стенки.
Задокументировать эффективность руководящих принципов ВОЗ по лечению детей с пневмонией и ВИЧ-инфекцией.
- LRI смертей:
Чтобы помочь разработать более эффективные меры по снижению смертности от LRI, подробно изучите эпидемиологию смертей от LRI в различных регионах, используя рутинные и современные лабораторные методы.
- Кислородная терапия:
Проведите исследования, чтобы показать эффективность кислорода для лечения тяжелых респираторных инфекций.
Соберите базовую информацию о наличии и доставке кислорода и его использовании в больницах в странах с низким уровнем дохода.
Изучите возможности пульсоксиметрии для оптимизации кислородной терапии в различных клинических условиях.
Провести исследования для улучшения специфичности клинических признаков при наложении признаков и симптомов малярии и пневмонии.
Изучите быстрые диагностические тесты на малярию, чтобы оценить их эффективность в различении малярии и пневмонии.
Изучить влияние широкого применения котримоксазола на устойчивость к сульфадоксин-пириметамину к Plasmodium falciparum .
Этиология: Данные об этиологии пневмонии у детей несколько устарели, и необходимы новые этиологические исследования, в которых используются современные технологии для идентификации патогенов.
Выводы: обещания и ловушки
Фактические данные ясно показывают, что подход ВОЗ к ведению больных и более широкое использование имеющихся вакцин снизят смертность от ОРИ среди детей младшего возраста от половины до двух третей. Само по себе систематическое применение упрощенного ведения больных, стоимость которого достаточно низка, чтобы быть доступным практически для любой развивающейся страны, снизит смертность от ОРИ как минимум на треть.Срочно нужно воплотить эту информацию в жизнь.
Стратегия ведения случая должна применяться и проспективно оцениваться, чтобы возникающие проблемы устойчивости к противомикробным препаратам, снижение эффективности текущего лечения рекомендованными противомикробными препаратами или появление неожиданных патогенов могли быть обнаружены на ранней стадии и чтобы можно было быстро принять меры по исправлению положения. Если действия медицинских работников на уровне сообществ будут дополнены внедрением стратегии ИВБДВ на всех уровнях первичной медико-санитарной помощи, то применение и оценка этой стратегии будет проще.Такая синергия также может помочь в сборе информации, которая поможет в дальнейшей точной настройке клинических признаков, чтобы даже сельские медицинские работники могли лучше отличить бронхиолит и хрипы от бактериальной пневмонии. Критике того, что меры по ведению пациентов могут привести к чрезмерному использованию противомикробных препаратов, следует противодействовать путем документального подтверждения их чрезмерного и неправильного использования врачами и другими медицинскими работниками. Хотя наблюдается возрождение интереса к проведению вмешательств на уровне сообществ, наш анализ показывает, что это может оказаться нерентабельным.В самом деле, ведение пациентов с ОРИ в учреждении первого уровня все еще может быть наиболее рентабельным в сочетании с более эффективными поведенческими вмешательствами при обращении за медицинской помощью.
Международное медицинское сообщество только начинает осознавать потенциальные преимущества вакцин против Hib и пневмококка. В настоящее время они дороги по сравнению с вакцинами Расширенной программы иммунизации, но цена вакцины Hib может упасть с выходом на рынок большего числа производителей в ближайшие несколько лет. Тем не менее, убедительные доказательства экономической эффективности вакцин необходимы для облегчения принятия национальных решений по внедрению вакцины и ее устойчивому использованию.В странах с низким уровнем дохода одних только положительных соотношений затрат и выгод и экономической эффективности оказывается недостаточно для включения этих вакцин в национальные программы иммунизации.
Ссылки
- Аддо-Йобо Э., Чисака Н., Хассан М., Хибберд П., Лозано Дж. М., Джина П. и др. Пероральный амоксициллин по сравнению с инъекционным пенициллином при тяжелой пневмонии у детей в возрасте от 3 до 59 месяцев: рандомизированное многоцентровое исследование эквивалентности. Ланцет. 2004. 364 (9440): 1141–48. [PubMed: 15451221]
- Адегбола Р.A., Falade A. G., Sam B. E., Aidoo M., Baldeh I., Hazlett D. et al. Этиология пневмонии у недоедающих и хорошо питающихся детей Гамбии. Журнал детских инфекционных болезней. 1994. 13 (11): 975–82. [PubMed: 7845751]
- Адегбола Р. А., Усен С. О., Вебер М., Ллойд-Эванс Н., Джоб К., Малхолланд К. и др. Haemophilus influenzae Менингит типа B в Гамбии после введения конъюгированной вакцины. Ланцет. 1999; 354 (9184): 1091–92. [PubMed: 10509502]
Агилар, А.М., Р. Альварадо, Д. Кордеро, П. Келли, А. Замора и Р. Сальгадо. 1998 г. Обследование смертности в Боливии: окончательный отчет — исследование и определение причин смерти детей в возрасте до пяти лет . Вена, Вирджиния: Базовая поддержка проекта институционализации выживания детей.
- Берман С. Средний отит у детей. Медицинский журнал Новой Англии. 1995a; 332 (23): 1560–65. [PubMed: 7739711]
- ———. 1995b Отит медиа в развивающихся странах, педиатрия 961, часть 1126–31. [PubMed: 7596700]
Бхаттачарья, К., П. Винч, К. ЛеБан и М. Тьен. 2001. «Стимулы и сдерживающие факторы для работников здравоохранения в сообществе: как они влияют на мотивацию, удержание и устойчивость». Basic Support for Institutionalizing Child Survival Project Агентства США по международному развитию, Арлингтон, Вирджиния.
- Блэк Р. Э., Моррис С. С., Брайс Дж. Где и почему 10 миллионов детей умирают каждый год? Ланцет. 2003. 361 (9376): 2226–34. [PubMed: 12842379]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Льюис Э., Рэй П., Хансен Дж. Р. Группа Центра изучения вакцин Kaiser Permanente Северной Калифорнии. Эффективность, безопасность и иммуногенность гептавалентной пневмококковой конъюгированной вакцины у детей. Журнал детских инфекционных болезней. 2000. 19 (3): 187–95. [PubMed: 10749457]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Хиатт Р. Безопасность, иммуногенность и эффективность олигосахаридного конъюгата у младенцев Haemophilus influenzae Вакцина типа B для населения США: возможные последствия для оптимального использования.Журнал инфекционных болезней. 1992; 165 (Приложение 43): S139–43. [PubMed: 1588149]
- Блэк С. Б., Шайнфилд Х. Р., Хансен Дж., Элвин Л., Лауфер Д., Малиноски Ф. Постлицензионная оценка эффективности семивалентной пневмококковой конъюгированной вакцины. Журнал детских инфекционных болезней. 2001. 20 (12): 1105–7. [PubMed: 11740313]
- Бобат Р., Кувадия Х. М., Мудли Д., Коутсудис А. Смертность в когорте детей, рожденных ВИЧ-инфицированными женщинами из Дурбана, Южная Африка. Южноафриканский медицинский журнал.1999. 89 (6): 646–48. [PubMed: 10443216]
- Booy R., Hodgson S., Carpenter L., Mayon-White R. T., Slack M. P., Macfarlane J. A. et al. Эффективность Haemophilus influenzae PRP-T конъюгированной вакцины типа B. Ланцет. 1994. 344 (8919): 362–66. [PubMed: 7 6]
- Брайс Дж., Боски-Пинто К., Сибуя К., Блэк Р. Э. Справочная группа ВОЗ по эпидемиологии здоровья детей. . Оценки ВОЗ причин смерти у детей. Ланцет. 2005; 365: 1147–52. [PubMed: 15794969]
- Кэмпбелл Х., Армстронг Дж. Р. М., Байасс П. Загрязнение воздуха в помещениях в развивающихся странах и острая респираторная инфекция у детей. Ланцет. 1989; 1 (8645): 1012. [PubMed: 2565480]
- Кэмпбелл Х., Байасс П., Ламонт А. С., Форги И. М., О’Нил К. П., Ллойд-Эанс Н., Гринвуд Б. М. Оценка клинических критериев для выявления тяжелых острых инфекций нижних дыхательных путей у детей. Ланцет. 1989; 1 (8633): 297–99. [PubMed: 2563457]
- Группа изучения догоняющих событий. Клиническая эффективность ко-тримоксазола по сравнению с амоксициллином дважды в день для лечения пневмонии: рандомизированное контролируемое клиническое испытание в Пакистане.Архив болезней детства. 2002; 86: 113–18. [Бесплатная статья PMC: PMC1761064] [PubMed: 11827905]
- Cherian T., John T. J., Simoes E. A., Steinhoff M. C., John M. Оценка простых клинических признаков для диагностики острой инфекции нижних дыхательных путей. Ланцет. 1988. 2: 125–28. [PubMed: 2899187]
- Cherian T., Simoes E. A., Steinhoff M. C., Chitra K., John M., Raghupathy P. et al. Бронхиолит в тропической южной Индии. Американский журнал болезней детей. 1990; 144 (9): 1026–30.[PubMed: 2396617]
- Каттс Ф. Т., Заман С. М. А., Энвере Г., Джаффар С., Левин О. С., Ококо Дж. Б. и др. Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное, двойное слепое, плацебо-контролируемое испытание. Ланцет. 2005; 365 (9465): 1139–46. [PubMed: 15794968]
- де Андраде А. Л., де Андраде Дж. Г., Мартелли К. М., Сильва С. А., де Оливейра Р. М., Коста М. С. и др. Эффективность конъюгированной вакцины Haemophilus influenzae B при детской пневмонии: исследование случай-контроль в Бразилии.Международный журнал эпидемиологии. 2004. 33 (1): 173–81. [PubMed: 15075166]
- Денни Ф. У. мл. Клиническое влияние респираторных вирусных инфекций человека. Американский журнал респираторной медицины и реанимации. 1995; 152 (4, часть 2): S4–12. [PubMed: 7551411]
- Dobson M. Концентраторы кислорода обеспечивают экономию средств для развивающихся стран: исследование, основанное на Новой Гвинее. Анестезия. 1991; 146: 217–19. [PubMed: 2014901]
- Дуглас Р. М., Майлз Х. Б. Вакцинация против Streptococcus pneumoniae в детстве: отсутствие очевидной пользы для маленьких австралийских детей.Журнал инфекционных болезней. 1984. 149 (6): 861–69. [PubMed: 6376653]
- Герцог Т., Мгоне Дж., Фрэнк Д. Гипоксемия у детей с тяжелой пневмонией в Папуа-Новой Гвинее. Международный журнал туберкулеза и болезней легких. 2001; 5: 511–19. [PubMed: 11409576]
- Эскола Дж., Кайхти Х., Такала А. К., Пелтола Х., Роннберг П. Р., Кела Э. и др. Рандомизированное проспективное полевое испытание конъюгированной вакцины для защиты младенцев и детей младшего возраста от инвазивной болезни Haemophilus influenzae типа B.Медицинский журнал Новой Англии. 1990. 323 (20): 1381–87. [PubMed: 2233904]
- Eskola J., Kilpi T., Palmu A., Jokinen J., Haapakoski J., Herva E. et al. Эффективность пневмококковой конъюгированной вакцины против острого среднего отита. Медицинский журнал Новой Англии. 2001. 344 (6): 403–409. [PubMed: 11172176]
- Фарли Дж., Кинг Дж. К., Наир П., Хайнс С. Э., Трессиер Р. Л., Винк П. Э. Инвазивное пневмококковое заболевание среди инфицированных и неинфицированных детей матерей с инфекцией, вызванной вирусом иммунодефицита человека.Журнал педиатрии. 1994; 124: 853–58. [PubMed: 8201466]
- Фиддиан-Грин Р. Г., Бейкер С. Нозокомиальная пневмония у критически больных: продукт аспирации или перемещения? Реанимационная медицина. 1991; 19: 763–69. [PubMed: 2055052]
- Файерман Б., Блэк С. Б., Шайнфилд Х. Р., Ли Дж., Льюис Э., Рэй П. Воздействие пневмококковой конъюгированной вакцины на средний отит. Журнал детских инфекционных болезней. 2003. 22 (1): 10–16. [PubMed: 12544402]
- Фритцелл Б., Плоткин С. Эффективность и безопасность вакцины, конъюгированной с капсульным полисахаридом столбняка и белком столбняка, Haemophilus influenzae.Журнал педиатрии. 1992. 121 (3): 355–62. [PubMed: 1517908]
- Гесснер Б. Д., Сутанто А., Линехан М., Джелантик И. Г., Флетчер Т., Герудуг И. К. и др. Заболеваемость гемофильной пневмонией и менингитом, предотвращаемым вакцинацией, Haemophilus Influenzae у индонезийских детей: рандомизированное исследование вакцины Hamlet. Ланцет. 2005; 365 (9453): 43–52. [PubMed: 15643700]
- Гафур А., Номани Н. К., Исхак З., Заиди С. З., Анвар Ф., Берни М. И. и др. Диагностика острых инфекций нижних дыхательных путей у детей в Равалпинди и Исламабаде, Пакистан.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S907–14. [PubMed: 2270413]
- Гилкс К. Ф. Пневмококковая болезнь и ВИЧ-инфекция. Анналы внутренней медицины. 1993; 118: 393–94. [PubMed: 8430986]
- Гоэль А., Бэмфорд Л., Хансло Д., Хасси Г. Первичная стафилококковая пневмония у детей раннего возраста: обзор 100 случаев. Журнал тропической педиатрии. 1999. 45 (4): 233–36. [PubMed: 10467836]
- Hament J. M., Aerts P. C., Fleer A., Van Dijk H., Harmsen T., Kimpen J. L., Wolfs T.F. Повышенная адгезия Streptococcus pneumoniae к эпителиальным клеткам человека, инфицированным респираторно-синцитиальным вирусом. Педиатрические исследования. 2004; 55 (6): 972–78. [PubMed: 15103015]
- Heath P. T. Haemophilus influenzae Конъюгированные вакцины типа B: обзор данных об эффективности. Журнал детских инфекционных болезней. 1998. 17 (9 доп.): S117–22. [PubMed: 9781743]
- Hortal M., Mogdasy C., Russi J. C., Deleon C., Suarez A. Микробные агенты, ассоциированные с пневмонией у детей из Уругвая.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S915–22. [PubMed: 2270414]
- Икеогу М. О., Вольф Б., Мате С. Легочные проявления у ВИЧ-серопозитивных и недоедающих детей в Зимбабве. Архив болезней детства. 1997. 76: 124–28. [Бесплатная статья PMC: PMC1717076] [PubMed:
- 01]
- Джина П. М., Кувадия Х. М., Кристал В. Pneumocystis carinii и cytomegalo Вирусные инфекции у тяжелобольных ВИЧ-инфицированных африканских младенцев. Анналы тропической педиатрии.1996; 16: 361–68. [PubMed: 8985536]
- Цзян З., Нагата Н., Молина Э., Бакалетз Л. О., Хокинс Х., Патель Дж. А. Усиленное прикрепление нетипируемого Haemophilus influenzae , инфицированного респираторно-синцитиальным вирусом, к респираторным эпителиальным клеткам, инфицированным синцитиальным вирусом. Инфекция и иммунитет. 1999; 67: 187–92. [Бесплатная статья PMC: PMC96295] [PubMed: 9864214]
Джон Т. Дж. 1994. «Кто определяет национальную политику здравоохранения?» In Вакцинация и здоровье в мире: четвертый ежегодный форум общественного здравоохранения Лондонской школы гигиены и тропической медицины , изд.Каттс Ф. Т., Смит П. Г., 205–11. Чичестер, Великобритания: Джон Вили.
- Джон Т. Дж., Чериан Т., Стейнхофф М. К., Симоэс Э. А., Джон М. Этиология острых респираторных инфекций у детей в тропиках на юге Индии. Обзоры инфекционных болезней. 1991; 13 (Приложение 6): S463–69. [PubMed: 1862277]
- Камат К. Р., Фельдман Р. А., Рао П. С., Уэбб Дж. К. Инфекция и болезнь в группе южноиндийских семей. Американский журнал эпидемиологии. 1969; 89: 375–83. [PubMed: 5778926]
- Карма П., Луотонен Дж., Тимонен М., Понтинен С., Пукандер Дж., Херва Э. и др. Эффективность пневмококковой вакцины против рецидивирующего среднего отита: предварительные результаты полевых испытаний в Финляндии. Annals of Otology, Rhinology, and Laryngology Suppl. 1980. 89 (3, часть 2): 357–62. [PubMed: 6778346]
Картасасмита, С. 2003. «Пероральный котримоксазол три или пять дней при нетяжелой пневмонии». Документ, представленный на Консультативном совещании Всемирной организации здравоохранения по обзору текущих исследований и лечению острых респираторных инфекций, Женева, 29 сентября — 1 октября.
- Килпи Т., Ахман Х., Йокинен Дж., Ланкинен К. С., Палму А., Саволайнен Х. и др. Защитная эффективность второй пневмококковой конъюгированной вакцины против пневмококкового острого среднего отита у младенцев и детей: рандомизированное контролируемое испытание семивалентной конъюгированной вакцины комплекса пневмококкового полисахарида и менингококкового белка внешней мембраны с 7-валентными соединениями у 1666 детей. Клинические инфекционные болезни. 2003. 37 (9): 1155–64. [PubMed: 14557958]
- Клугман К. П., Мадхи С. А., Хюбнер Р.E., Kohberger R., Mbelle N., Pierce N. et al. Испытание пневмококковой конъюгированной вакцины 9-Valent у детей с ВИЧ-инфекцией и без нее. Медицинский журнал Новой Англии. 2003. 349 (14): 1341–48. [PubMed: 14523142]
- Колстад П. Р., Бернем Г., Калтер Х. Д., Кения-Мугиша Н., Блэк Р. Э. Комплексное ведение детских болезней в Западной Уганде. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 77–85. [Бесплатная статья PMC: PMC2486998] [PubMed: 9529720]
- Lagos R., Хорвиц И., Торо Дж., Сан Мартин О., Абрего П., Бустаманте С. и др. Крупномасштабная, постлицензионная, селективная вакцинация чилийских младенцев конъюгированной вакциной PRP-T: практичность и эффективность в предотвращении инвазивных инфекций Haemophilus influenzae типа B. Журнал детских инфекционных болезней. 1996; 15: 216–22. [PubMed: 8852909]
- Леманн Д., Маршалл Т. Ф., Райли И. Д., Альперс М. П. Влияние пневмококковой вакцины на заболеваемость острыми инфекциями нижних дыхательных путей у детей Папуа-Новой Гвинеи.Анналы тропической педиатрии. 1991. 11 (3): 247–57. [PubMed: 1719924]
- Левин О. С., Лагос Р., Муньос А., Вильяроэль Дж., Альварес А. М., Абрего П. и др. Определение бремени пневмонии у детей, которую можно предотвратить с помощью вакцинации против Haemophilus influenzae Тип B. Журнал детских инфекционных болезней. 1999. 18 (12): 1060–64. [PubMed: 10608624]
- Лукас С. Б., Пикок С. С., Хунноу А., Браттегаард К., Коффи К., Хонд М. и др. Заболевание детей, инфицированных ВИЧ в Абиджане, Кот-д’Ивуар.Британский медицинский журнал. 1996; 312: 335–38. [Бесплатная статья PMC: PMC2350283] [PubMed: 8611829]
- Мадхи С.А., Петерсен К., Мадхи А., Хосал М., Клугман К.П. Повышенное бремя болезней и устойчивость бактерий к антибиотикам, вызывающая тяжелые инфекции нижних дыхательных путей, приобретенные в сообществе Дети, инфицированные вирусом иммунодефицита человека 1. Клинические инфекционные болезни. 2000. 31: 170–76. [PubMed: 10
- 7]
- Мадхи С. А., Петерсен К., Мадхи А., Васас А., Клугман К. П.Влияние вируса иммунодефицита человека типа 1 на спектр заболеваний Streptococcus pneumoniae у детей Южной Африки. Журнал детских инфекционных болезней. 2000. 19 (12): 1141–47. [PubMed: 11144373]
- Макела П. Х., Сибаков М., Херва Э., Хенрихсен Дж., Луотонен Дж., Тимонен М. и др. Пневмококковая вакцина и средний отит. Ланцет. 1980; 2 (8194): 547–51. [PubMed: 6106735]
Управленческие науки для здравоохранения. 2005. Международный справочник по индикаторам цен на лекарства .Кембридж, Массачусетс: Управленческие науки для здоровья.
- МакКуллерс Дж. А., Бартмесс К. С. Роль нейраминидазы в летальном синергизме между вирусом гриппа и Streptococcus pneumoniae . Журнал инфекционных болезней. 2003. 187: 1000–9. [PubMed: 12660947]
- Монто А. С., Ульман Б. М. Острое респираторное заболевание в американском сообществе: исследование Текумсе. Журнал Американской медицинской ассоциации. 1974. 227 (2): 164–69. [PubMed: 4357298]
- Малхолланд К., Усен С., Адегбола Р., Вебер Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998. 352 (9127): 575–76. [PubMed: 9716087]
- Малхолланд Э. К., Симоэс Э. А., Касталес М. О., МакГрат Э. Дж., Маналак Э. М., Гоув С. Стандартизированная диагностика пневмонии в развивающихся странах. Журнал детских инфекционных болезней. 1992; 11: 77–81. [PubMed: 1741202]
- Малхолланд К., Хилтон С., Адегбола Р., Усен С., Опарауго А., Омосиго С. и др. Рандомизированное исследование Haemophilus influenzae вакцины конъюгированной против столбняка с белком типа B для профилактики пневмонии и менингита у младенцев в Гамбии.Ланцет. 1997. 349 (9060): 1191–97. [PubMed:
- 39]
- Натху К. Дж., Нкрума Ф. К., Ндлову Д., Нхембе Д., Пири Дж., Ково Х. Острая инфекция нижних дыхательных путей у госпитализированных детей в Зимбабве. Анналы тропической педиатрии. 1993; 13: 253–61. [PubMed: 7505550]
- Нойзил К. М., Чжу Ю., Гриффин М. Р., Эдвардс К. М., Томпсон Дж. М., Толлефсон С. Дж., Райт П. Ф. Бремя межпандемического гриппа у детей младше 5 лет: 25-летнее перспективное исследование. Журнал инфекционных болезней.2002; 185: 147–52. [PubMed: 11807687]
- Nolan T., Angos P., Cunha A. J., Muhe L., Qazi S., Simoes E. A. et al. Качество стационарной помощи тяжелобольным детям в менее развитых странах. Ланцет. 2001. 357 (9250): 106–10. [PubMed: 11197397]
- Обаро С., Лич А., Макадам К. В. Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998; 352 (9127): 575. [PubMed: 9716086]
- О’Брайен К. Л., Моултон Л. Х., Рид Р., Уэзерхольц Р., Оски Дж., Браун Л. и др. Эффективность и безопасность семивалентной конъюгированной пневмококковой вакцины у детей американских индейцев: групповое рандомизированное исследование.Ланцет. 2003. 362 (9381): 355–61. [PubMed: 12 8]
- Оньянго Ф. Э., Стейнхофф М. К., Вафула Э. М., Вариуа С., Мусиа Дж., Китони Дж. Гипоксемия у маленьких кенийских детей с острой инфекцией нижних дыхательных путей. Британский медицинский журнал. 1993. 306 (6878): 612–15. [Бесплатная статья PMC: PMC1676956] [PubMed: 8369033]
- Пандей М. Р., Даулер Н. М., Старбак Э. С., Хьюстон Р. М., Макферсон К. Снижение общей смертности детей в возрасте до пяти лет в Западном Непале с помощью противомикробного лечения пневмонии на уровне местных сообществ.Ланцет. 1991. 338 (8773): 993–97. [PubMed: 1681351]
- Пандей М. Р., Шарма П. Р., Губхаджу Б. Б., Шакья Г. М., Неупане Р. П., Гаутам А. и др. Воздействие пилотной программы борьбы с острыми респираторными инфекциями (ОРИ) в сельском сообществе Горного региона Непала. Анналы тропической педиатрии. 1989. 9 (4): 212–20. [PubMed: 2482002]
- Педерсон Дж., Найроп М. Анестезиологическое оборудование для развивающихся стран. Британский журнал анестезии. 1991; 66: 264–70. [PubMed: 1817634]
- Пейрис Дж.S., Yu W. C., Leung C. W., Cheung C. Y., Ng W. F., Nicholls J. M. et al. Повторное появление заболевания подтипа H5N1 гриппа человека со смертельным исходом. Ланцет. 2004; 363 (9409): 617–19. [Бесплатная статья PMC: PMC7112424] [PubMed: 14987888]
- Перкинс Б. А., Цукер Дж. Р., Отинео Дж., Джафари Х. С., Пакстон Л., Редд С. С. и др. Оценка алгоритма интегрированного ведения детских болезней в районе Кении с высоким уровнем передачи малярии. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 33–42.[Бесплатная статья PMC: PMC2487004] [PubMed: 9529716]
Киамбао, Б. П., Э. А. Симоес, Э. Абучехо-Ладесма, Л. С. Гозум, С. П. Луписан, Л. Т. Сомбреро и П. Дж. Рууту (Консорциум ARIVAC). Скоро. «Серьезные детские инфекции, приобретенные в сообществе, в сельских районах Азии (остров Бохол, Филиппины)». Журнал детских инфекционных болезней .
Редд С. Диагностика и лечение острых респираторных инфекций в Лесото. Политика и управление здравоохранением. 1994; 5: 255–60.
- Райли И. Д., Эверингем Ф. А., Смит Д. Э., Дуглас Р. М. Иммунизация поливалентной пневмококковой вакциной: влияние респираторной смертности у детей, живущих в Высокогорье Новой Гвинеи. Архив болезней детства. 1981. 56 (5): 354–57. [Бесплатная статья PMC: PMC1627425] [PubMed: 7020609]
- Райли И. Д., Леманн Д., Альперс М. П. Испытания пневмококковой вакцины в Папуа-Новой Гвинее: взаимосвязь между эпидемиологией пневмококковой инфекции и эффективностью вакцины. Обзоры инфекционных болезней.1991; 13 (Приложение 6): S535–41. [PubMed: 1862283]
- Рудан И., Томаскович Л., Боски-Пинто К., Кэмпбелл Х. Справочная группа ВОЗ по эпидемиологии здоровья детей. Глобальная оценка заболеваемости клинической пневмонией среди детей в возрасте до пяти лет. Бюллетень Всемирной организации здравоохранения. 2004. 82 (12): 895–903. [Бесплатная статья PMC: PMC2623105] [PubMed: 15654403]
Рудан и другие. Скоро.
- Santosham M., Wolff M., Reid R., Hohenboken M., Bateman M., Goepp J.и другие. Эффективность конъюгированной вакцины, состоящей из Haemophilus influenzae типа B и Neisseria meningitidis Внешнемембранного белкового комплекса, у младенцев навахо. Медицинский журнал Новой Англии. 1991. 324 (25): 1767–72. [PubMed: 1
6]
- Сазавал С., Блэк Р. Е. Группа исследований по ведению больных с пневмонией: влияние ведения больных с пневмонией на смертность новорожденных, младенцев и детей дошкольного возраста — метаанализ испытаний на уровне сообществ. Ланцетные инфекционные болезни.2003; 3: 547–56. [PubMed: 12954560]
- Schellenberg J. A., Victora C.G., Mushi A., de Savigny D., Schellenberg D., Mshinda H. et al. Неравенство среди очень бедных: здравоохранение для детей в сельских районах Южной Танзании. Ланцет. 2003. 361 (9357): 561–66. [PubMed: 12598141]
- Шнайдер Г. Обеспечение кислородом в сельских районах Африки: личный опыт. Международный журнал туберкулеза и болезней легких. 2001. 5 (6): 524–26. [PubMed: 11409578]
Шумахер, Р., Э. Сведберг, М.О. Диалло, Д. Р. Кейта, Х. Кальтер, О. Паша. 2002. Исследование смертности в Гвинее: исследование причин смерти детей в возрасте до пяти лет . Арлингтон, Вирджиния: Спасите детей и базовая поддержка для институционализации проекта выживания детей.
- Шэнн Ф. Этиология тяжелой пневмонии у детей в развивающихся странах. Детская инфекционная болезнь. 1986. 5 (2): 247–52. [PubMed: 3952013]
- Шенн Ф., Граттен М., Гермер С., Линнеманн В., Хазлетт Д., Пейн Р. Этиология пневмонии у детей в больнице Горока, Папуа-Новая Гвинея.Ланцет. 1984; 2 (8402): 537–41. [PubMed: 6147602]
- Шэнн Ф., Харт К., Томас Д. Острые инфекции нижних дыхательных путей у детей: возможные критерии отбора пациентов для антибактериальной терапии и госпитализации. Бюллетень Всемирной организации здравоохранения. 1984; 62: 749–51. [Бесплатная статья PMC: PMC2536213] [PubMed: 6334573]
- Simoes E. A. Респираторно-синцитиальная вирусная инфекция. Ланцет. 1999. 354 (9181): 847–52. [PubMed: 10485741]
- Симоэс Э. А., Деста Т., Тессема Т., Gerbresellassie T., Dagnew M., Gove S. Эффективность медицинских работников после обучения комплексному ведению детских болезней в Гондэре, Эфиопия. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 43–53. [Бесплатная статья PMC: PMC2487005] [PubMed: 9529717]
- Слойер Дж. Л. Дж., Плуссард Дж. Х., Хоуи В. М. Эффективность пневмококковой полисахаридной вакцины в предотвращении острого среднего отита у младенцев в Хантсвилле, Алабама. Обзоры инфекционных болезней. 1981; 3 (Прил.): S119–23. [PubMed: 7280444]
- Стенсбаль Л.Г., Девасундарам Дж. К., Симоэс Э. А. Эпидемии респираторно-синцитиального вируса: взлеты и падения сезонного вируса. Журнал детских инфекционных болезней. 2003; 22 (2 доп.): S21–32. [PubMed: 12671449]
- Штраус В. Л., Кази С. А., Кунди З., Номани Н. К., Шварц Б. Группа по изучению ко-тримоксазола. Устойчивость к противомикробным препаратам и клиническая эффективность ко-тримоксазола по сравнению с амоксициллином при пневмонии у детей в Пакистане: рандомизированное контролируемое исследование. Ланцет. 1998. 352: 270–74. [PubMed: 96]
- Темпл К., Гринвуд Б., Инскип Х., Холл А., Коскела М., Лейнонен М. Ответ антител на пневмококковую капсульную полисахаридную вакцину у африканских детей. Журнал детских инфекционных болезней. 1991. 10 (5): 386–90. [PubMed: 2067888]
- Тупаси Т. Э., Лусеро М. Г., Магдангал Д. М., Мангубат Н. В., Сунико М. Э., Торрес К. У. и др. Этиология острой инфекции нижних дыхательных путей у детей из Алабанга, Метро Манила. Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S929–39. [PubMed: 2270415]
ЮНЭЙДС (Объединенная программа Организации Объединенных Наций по ВИЧ / СПИДу).2002. Обновление эпидемии СПИДа . Женева: ЮНЭЙДС.
- Усен С., Вебер М., Малхолланд К., Джаффар С., Опарауго А., Омосиго С. и др. Клинические предикторы гипоксемии у детей Гамбии с острой инфекцией нижних дыхательных путей: проспективное когортное исследование. Британский медицинский журнал. 1999. 318 (7176): 86–91. [Бесплатная статья PMC: PMC27680] [PubMed: 9880280]
- Van den Hoogen BG, de Jong JC, Groen J., Kuiken T., de Groot R., Fouchier RA, Osterhaus AD Недавно обнаруженный человеческий пневмовирус, выделенный у детей раннего возраста при заболевании дыхательных путей.Природная медицина. 2001; 7: 719–24. [Бесплатная статья PMC: PMC7095854] [PubMed: 11385510]
- Вуори-Холопайнен Э., Пелтола Х. Переоценка легочного легочного: обзор старого метода для лучшей этиологической диагностики детской пневмонии. Клинические инфекционные болезни. 2001. 32 (5): 715–26. [PubMed: 11229839]
- Вебер М. В., Малхолланд Э. К., Джаффар С., Трёдссон Х., Гоув С., Гринвуд Б. М. Оценка алгоритма комплексного ведения детских болезней в районе с сезонной малярией в Гамбии.Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 25–32. [Бесплатная статья PMC: PMC2486992] [PubMed: 9529715]
- Венгер Дж. Д., ДиФабио Дж., Ландаверде Дж. М., Левин О. С., Гаафар Т. Внедрение конъюгированных вакцин против Hib в непромышленно развитых странах: опыт в четырех странах, которые «недавно начали принимать» . Вакцина. 1999. 18 (78): 736–42. [PubMed: 10547434]
Wenger, J. D., and M. M. Levine, eds. 1997. Эпидемиологическое влияние конъюгированной вакцины на инвазивное заболевание, вызываемое гемофильной палочкой Haemophilus influenzae Тип B .Нью-Йорк: Марсель Деккер.
- Уитни К. Г., Фарли М. М., Хадлер Дж., Харрисон Л. Х., Беннет Н. М., Линфилд Р. и др. Снижение инвазивного пневмококкового заболевания после введения протеин-полисахаридной конъюгированной вакцины. Медицинский журнал Новой Англии. 2003. 348 (18): 1737–46. [PubMed: 12724479]
ВОЗ (Всемирная организация здравоохранения). 1990. «Антибиотики в лечении острых респираторных инфекций у детей раннего возраста». Неопубликованный документ WHO / ARI / 90.10, доступный по запросу в Отделе здоровья и развития детей, бывшего Отдела борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 1991. «Ведение маленького ребенка с острой респираторной инфекцией. Модуль обучения навыкам супервизии». Неопубликованный документ, доступный по запросу в Отделе здоровья и развития детей ВОЗ, бывшем Отделении борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 2002. Многострановая оценка эффективности, затрат и воздействия ИВБДВ (MCE): отчет о ходе работы, май 2001 г. — апрель 2002 г. .WHO / FCH / CAH / 02.16. Женева: Отдел здоровья и развития детей и подростков, ВОЗ.
———. 2003 г. Консультативное совещание по ведению детей с пневмонией и ВИЧ-инфекцией, 30–31 января 2003 г., Хараре, Зимбабве . WHO / FCH / CAH / 03.4. Женева: ВОЗ.
- ———. 2004a Группа по обзору Haemophilus influenzae Бремя болезни типа B (Hib) в Бангладеш, Индонезия и других азиатских странах, Бангкок, 28–29 января 2004 г. Еженедельный эпидемиологический отчет 79 (18): 173–75.[PubMed: 15168565]
———. 2004b. «Совместное заявление ВОЗ / ЮНИСЕФ: ведение пневмонии в общественных местах». WHO / FCH / CAG / 04.06. ВОЗ, Женева.
ВОЗ (Всемирная организация здравоохранения) и здоровье детей-подростков. Скоро. Отчет о методологии и предположениях, использованных для оценки затрат на расширение отдельных мероприятий по охране здоровья детей до 95% с целью снижения смертности детей в возрасте до пяти лет . Женева: ВОЗ.
- Уильямс Б. Г., Гоус Э., Боски-Пинто К., Брайс Дж., Дай С. Оценки глобального распределения детской смертности от острых респираторных инфекций. Ланцетные инфекционные болезни. 2002; 2: 25–32. [PubMed: 118]
Всемирный банк. 2002. Показатели мирового развития . CD-ROM. Вашингтон, округ Колумбия: Всемирный банк.
- Цви К. Дж., Петтифиор Дж. М., Содерлунд Н. Педиатрическая больница при городской региональной больнице Южной Африки: влияние ВИЧ, 1992–1997. Анналы тропической педиатрии. 1999; 19: 135–42. [PubMed: 106]
Острые респираторные инфекции у детей — приоритеты борьбы с заболеваниями в развивающихся странах
Острые респираторные инфекции (ОРИ) классифицируются как инфекции верхних дыхательных путей (URI) или инфекции нижних дыхательных путей (LRIs).Верхние дыхательные пути состоят из дыхательных путей от ноздрей до голосовых связок в гортани, включая придаточные пазухи носа и среднее ухо. Нижние дыхательные пути покрывают продолжение дыхательных путей от трахеи и бронхов к бронхиолам и альвеолам. ОРИ не ограничиваются дыхательными путями и имеют системные эффекты из-за возможного распространения инфекции или микробных токсинов, воспаления и снижения функции легких. Дифтерия, коклюш (коклюш) и корь — это болезни, которые можно предотвратить с помощью вакцин, которые могут иметь компонент дыхательных путей, но также влияют на другие системы; они обсуждаются в главе 20.
За исключением неонатального периода, ОРИ являются наиболее частой причиной как болезней, так и смертности у детей в возрасте до пяти лет, у которых в среднем от трех до шести эпизодов ОРИ ежегодно, независимо от того, где они живут или каково их экономическое положение (Kamath and others 1969; Монто и Ульман 1974). Тем не менее, соотношение легких и тяжелых заболеваний варьируется между странами с высоким и низким уровнем доходов, и из-за различий в конкретной этиологии и факторах риска тяжесть LRIs у детей в возрасте до пяти лет хуже в развивающихся странах, что приводит к более высокому уровню заболеваемости. летальность.Хотя медицинская помощь может до некоторой степени снизить как тяжесть заболевания, так и летальный исход, многие тяжелые формы LRI не поддаются лечению, в основном из-за отсутствия высокоэффективных противовирусных препаратов. Ежегодно умирает около 10,8 миллиона детей (Black, Morris, and Bryce, 2003). По оценкам, в 2000 году 1,9 миллиона из них умерли от ОРИ, 70 процентов из них — в Африке и Юго-Восточной Азии (Williams and others 2002). По оценкам Всемирной организации здравоохранения (ВОЗ), 2 миллиона детей в возрасте до пяти лет умирают от пневмонии ежегодно (Bryce and others 2005).
Причины ОРИ и бремя болезней
ОРИ у детей уносят тяжелый урон жизни, особенно там, где медицинская помощь недоступна или за ней не обращаются.
Инфекции верхних дыхательных путей
URI являются наиболее распространенными инфекционными заболеваниями. К ним относятся ринит (простуда), синусит, инфекции уха, острый фарингит или тонзиллофарингит, эпиглоттит и ларингит, из которых инфекции уха и фарингит вызывают более серьезные осложнения (глухота и острая ревматическая лихорадка соответственно).Подавляющее большинство URI имеют вирусную этиологию. Риновирусы составляют от 25 до 30 процентов URI; респираторно-синцитиальные вирусы (РСВ), вирусы парагриппа и гриппа, метапневмовирус человека и аденовирусы — от 25 до 35 процентов; вирусы короны на 10 процентов; и неопознанные вирусы для остальных (Denny 1995). Поскольку большинство URI являются самоограничивающимися, их осложнения более важны, чем инфекции. Острые вирусные инфекции предрасполагают детей к бактериальным инфекциям носовых пазух и среднего уха (Berman 1995a), а аспирация инфицированных секретов и клеток может приводить к LRIs.
Острый фарингит
Острый фарингит у детей младшего возраста более чем в 70% случаев вызывается вирусами. Типичны легкое покраснение глотки, отек и увеличение миндалин. Стрептококковая инфекция редко встречается у детей до пяти лет и более часто встречается у детей старшего возраста. В странах с многолюдными условиями жизни и группами населения, которые могут иметь генетическую предрасположенность, постстрептококковые последствия, такие как острый ревматизм и кардит, распространены у детей школьного возраста, но могут также возникать у детей младше пяти лет.Острый фарингит в сочетании с развитием перепонки в горле почти всегда вызывается в развивающихся странах Corynebacterium diphtheriae . Однако при почти повсеместной вакцинации младенцев вакциной АКДС (дифтерия-столбняк-коклюш) дифтерия встречается редко.
Острая ушная инфекция
Острая ушная инфекция встречается у 30 процентов URI. В развивающихся странах с неадекватной медицинской помощью это может привести к перфорации барабанных перепонок и хроническим выделениям из уха в более позднем детстве и, в конечном итоге, к ухудшению слуха или глухоте (Berman 1995b).Хроническая ушная инфекция после повторных эпизодов острой ушной инфекции распространена в развивающихся странах, поражая от 2 до 6 процентов детей школьного возраста. Связанная с этим потеря слуха может приводить к инвалидности и влиять на обучение. Повторные ушные инфекции могут привести к мастоидиту, который, в свою очередь, может распространить инфекцию на мозговые оболочки. Мастоидит и другие осложнения, вызванные ОРВИ, являются причиной почти 5 процентов всех смертей от ОРИ во всем мире (Williams и др., 2002).
Инфекции нижних дыхательных путей
Распространенными инфекциями нижних дыхательных путей у детей являются пневмония и бронхиолит.Частота дыхания является ценным клиническим признаком для диагностики острой ЛРН у кашляющих и учащенно дышащих детей. Наличие втягивания нижней грудной стенки указывает на более тяжелое заболевание (Mulholland и др., 1992; Shann, Hart, and Thomas 1984).
В настоящее время наиболее частыми причинами вирусных LRIs являются RSV. Они, как правило, очень сезонные, в отличие от вирусов парагриппа, следующей наиболее частой причины вирусных LRI. Эпидемиология вирусов гриппа у детей в развивающихся странах заслуживает срочного исследования, поскольку доступны безопасные и эффективные вакцины.До эффективного использования противокоревой вакцины вирус кори был самой важной вирусной причиной заболеваемости и смертности детей, связанных с респираторными путями, в развивающихся странах.
Пневмония
И бактерии, и вирусы могут вызывать пневмонию. Бактериальная пневмония часто вызывается Streptococcus pneumoniae (пневмококк) или Haemophilus influenzae, в основном типом b (Hib) и иногда Staphylococcus aureus или другими стрептококками.Всего от 8 до 12 из множества типов пневмококка вызывают большинство случаев бактериальной пневмонии, хотя конкретные типы могут различаться у взрослых и детей и в разных географических регионах. Другие патогены, такие как Mycoplasma pneumoniae и Chlamydia pneumoniae, , вызывают атипичные пневмонии. Их роль как причины тяжелых заболеваний у детей до пяти лет в развивающихся странах неясна.
Бремя LRIs, вызванного Hib или S. pneumoniae , трудно определить, поскольку современные методы установления бактериальной этиологии не обладают чувствительностью и специфичностью.Результаты посева из глотки не всегда позволяют выявить патоген, являющийся причиной LRI. Бактериальные культуры образцов аспирата легких часто считаются золотым стандартом, но они не подходят для применения в полевых условиях. Обзор нескольких исследований Вуори-Холопайнен и Пелтола (2001) показывает, что на S. pneumoniae и Hib приходится от 13 до 34 процентов и от 1,4 до 42,0 процентов бактериальных пневмоний, соответственно, тогда как исследования Адегбола и др. (1994), Шэнн, Граттен и другие (1984) и Уолл и другие (1986) предполагают, что Hib составляет от 5 до 11 процентов случаев пневмонии.
Пониженные уровни клинической или радиологической пневмонии при клинических испытаниях девятивалентной пневмококковой конъюгированной вакцины дают оценку бремени болезней, предупреждаемых с помощью вакцины ( валентность указывает количество серотипов, от которых вакцина обеспечивает защиту; конъюгат относится к конъюгации полисахаридов с белковым остовом). В исследовании, проведенном в Гамбии, было предотвращено 37 процентов радиологической пневмонии, что отражает количество заболеваний, вызванных S.pneumoniae, , а смертность снизилась на 16 процентов (Cutts and others 2005).
Колонизация верхних дыхательных путей потенциально патогенными организмами и аспирация зараженных секретов участвуют в патогенезе бактериальной пневмонии у детей младшего возраста. Было показано, что инфицирование верхних дыхательных путей вирусом гриппа или RSV увеличивает связывание как H. influenzae (Jiang и др., 1999), так и S. pneumoniae (Hament and others 2004; McCullers and Bartmess 2003) с подкладкой. клетки носоглотки.Это открытие может объяснить, почему рост пневмококковой пневмонии идет параллельно с эпидемиями гриппа и RSV. Исследование, проведенное в Южной Африке, показало, что вакцинация девятивалентной пневмококковой конъюгированной вакциной снижает заболеваемость вирус-ассоциированной пневмонией, вызывающей госпитализацию, на 31 процент, что свидетельствует о том, что пневмококк играет важную роль в патогенезе вирус-ассоциированной пневмонии (Madhi, Petersen, Мадхи, Васас и др. 2000).
Попадание бактерий из кишечника с распространением через кровоток в легкие также было предложено для патогенеза грамотрицательных организмов (Fiddian-Green and Baker 1991), но такие бактерии являются необычными этиологическими агентами пневмонии у иммунокомпетентных дети.Однако у новорожденных и младенцев грудного возраста грамотрицательная пневмония не редкость (Quiambao готовится к печати).
Вирусы ответственны за от 40 до 50 процентов инфекций у младенцев и детей, госпитализированных по поводу пневмонии в развивающихся странах (Hortal and others 1990; John and others 1991; Tupasi and others 1990). Вирус кори, RSV, вирусы парагриппа, вирус гриппа типа A и аденовирусы являются наиболее важными причинами вирусной пневмонии. Рентгенологически сложно отличить вирусную пневмонию от бактериальной, отчасти потому, что поражения выглядят одинаково, а отчасти потому, что бактериальная суперинфекция возникает при гриппе, кори и инфекциях RSV (Ghafoor и др., 1990).
В развивающихся странах уровень летальности среди детей с вирусной пневмонией колеблется от 1,0 до 7,3 процента (John and others 1991; Stensballe, Devasundaram, and Simoes 2003), с бактериальной пневмонией от 10 до 14 процентов и со смешанной вирусной и вирусной пневмонией. бактериальные инфекции от 16 до 18 процентов (Ghafoor и др., 1990; Shann, 1986).
Бронхиолит
Бронхиолит возникает преимущественно в первый год жизни и с уменьшающейся частотой во второй и третий годы.Клинические признаки включают учащенное дыхание и втягивание нижней грудной стенки, лихорадку в одной трети случаев и хрипы (Cherian и др., 1990). Воспалительная обструкция мелких дыхательных путей, которая приводит к гиперинфляции легких и коллапсу сегментов легкого. Поскольку признаки и симптомы также характерны для пневмонии, работникам здравоохранения может быть сложно провести различие между бронхиолитом и пневмонией. Две особенности, которые могут помочь, — это определение сезонности RSV в данной местности и умение обнаруживать хрипы.RSV являются основной причиной бронхиолита во всем мире и могут вызывать до 70 или 80 процентов LRI в высокий сезон (Simoes 1999; Stensballe, Devasundaram и Simoes 2003). Недавно обнаруженный метапневмовирус человека также вызывает бронхиолит (Van den Hoogen и др., 2001), который неотличим от болезни RSV. Другие вирусы, вызывающие бронхиолит, включают вирус парагриппа 3-го типа и вирусы гриппа.
Грипп
Несмотря на то, что вирусы гриппа обычно вызывают инфекционные заболевания дыхательных путей у взрослых, они все чаще рассматриваются как важная причина инфекционных заболеваний кишечника у детей и, возможно, вторая по значимости причина госпитализации детей с ОРВ после RSV (Neuzil and others 2002). .Хотя грипп считается нечастым в развивающихся странах, его эпидемиология еще требует тщательного изучения. Потенциальное бремя гриппа как причина смерти детей неизвестно. Вирус гриппа типа A может вызывать сезонные вспышки, а тип B может вызывать спорадические инфекции. В последнее время вирус птичьего гриппа стал причиной инфекции, болезней и смерти небольшого числа людей, включая детей, в нескольких азиатских странах. Его потенциал для возникновения вспышек среди людей или пандемии неизвестен, но он может иметь разрушительные последствия для развивающихся стран (Peiris and others 2004) и может представлять угрозу для здоровья во всем мире.Новые штаммы вирусов типа А почти наверняка возникнут в результате мутации, как это произошло в случае пандемий в Азии и Гонконге в 1950-х и 1960-х годах.
ВИЧ-инфекция и педиатрические LRIs
Во всем мире 3,2 миллиона детей живут с ВИЧ / СПИДом, 85 процентов из них — в странах Африки к югу от Сахары (ЮНЭЙДС, 2002). В южной части Африки инфекционные заболевания, связанные с ВИЧ, составляют от 30 до 40 процентов случаев госпитализации детей и имеют показатель летальности от 15 до 34 процентов, что намного выше, чем 5-10 процентов для детей, не инфицированных ВИЧ (Bobat and others 1999; Мадхи, Петерсен, Мадхи, Хосал и другие, 2000; Натху и другие, 1993; Цви, Петтифиор и Содерлунд, 1999). Pneumocystis jiroveci и цитомегаловирус являются важными условно-патогенными инфекциями более чем у 50 процентов ВИЧ-инфицированных младенцев (Jeena, Coovadia, and Chrystal 1996; Lucas and others 1996). Грамотрицательные бактерии также важны для более чем 70 процентов ВИЧ-инфицированных детей с недостаточным питанием (Ikeogu, Wolf, and Mathe, 1997). Исследования пациентов подтвердили частую ассоциацию этих бактерий, но добавили S. pneumoniae и S. aureus в качестве важных патогенов (Gilks 1993; Goel and others 1999).В первом южноафриканском отчете об общем бремени инвазивной пневмококковой инфекции сообщается о 41,7-кратном увеличении числа ВИЧ-инфицированных детей по сравнению с неинфицированными детьми (Фарли и др., 1994).
Вмешательства
Вмешательства по борьбе с ОРИ можно разделить на четыре основные категории: иммунизация против конкретных патогенов, ранняя диагностика и лечение заболеваний, улучшение питания и более безопасная среда (John 1994). Первые два относятся к сфере компетенции системы здравоохранения, тогда как последние два относятся к сфере общественного здравоохранения и требуют многосекторального участия.
Прививки
Широкое использование вакцин против кори, дифтерии, коклюша, Hib, пневмококка и гриппа может существенно снизить заболеваемость ОРИ у детей в развивающихся странах. Влияние вакцин против кори, дифтерии и коклюша обсуждается в главе 20. Ограниченные данные о гриппе в развивающихся странах не позволяют провести подробный анализ потенциальных преимуществ этой вакцины. Поэтому в этой главе основное внимание уделяется потенциальному воздействию вакцин против Hib и пневмококка на LRI.
Вакцина против Hib
В настоящее время доступны три конъюгированные вакцины против Hib для применения у младенцев и детей младшего возраста. Эффективность вакцины против Hib в предотвращении инвазивных заболеваний (в основном менингита, но также и пневмонии) была хорошо задокументирована в нескольких исследованиях, проведенных в промышленно развитых странах (Black and others 1992; Booy and others 1994; Eskola and others 1990; Fritzell and Plotkin 1992; Heath 1998; Lagos and others 1996; Santosham and others 1991) и в одном исследовании в Гамбии (Mulholland and others 1997).Все исследования показали защитную эффективность более 90% против лабораторно подтвержденных инвазивных заболеваний, независимо от выбора вакцины. Следовательно, все промышленно развитые страны включают вакцину против Hib в свои национальные программы иммунизации, что приводит к фактической ликвидации инвазивной болезни Hib из-за иммунитета у вакцинированных и эффекта стада у тех, кто не вакцинирован. Имеющиеся данные из нескольких развивающихся стран показывают аналогичный эффект стада (Адегбола и др., 1999; Венгер и др., 1999).
Первоначальное обещание и последующее общее мнение заключалось в том, что вакцина против Hib предназначена для защиты от менингита, но в развивающихся странах вакцина, вероятно, будет иметь больший эффект в предотвращении LRI. Эффект легко измерить при инвазивных заболеваниях, включая бактериемическую пневмонию. Вакцина, вероятно, оказывает влияние на небактериемическую пневмонию, но этот эффект трудно определить количественно из-за отсутствия адекватного метода установления бактериальной этиологии. В Бангладеш, Бразилии, Чили и Гамбии вакцина против Hib была связана с уменьшением на 20-30 процентов числа госпитализированных с рентгенологически подтвержденной пневмонией (de Andrade and others 2004; Levine and others 1999; Mulholland and others 1997; WHO 2004a ).Однако результаты большого исследования в Ломбоке, Индонезия, не дали окончательных результатов в отношении влияния вакцины против Hib на пневмонию (Gessner and others 2005).
Пневмококковые вакцины
В настоящее время доступны два вида вакцин против пневмококков: 23-валентная полисахаридная вакцина (23-PSV), которая больше подходит для взрослых, чем для детей, и 7-валентная полисахаридная вакцина, конъюгированная с белком (7- PCV). 9-валентная вакцина (9-PCV) прошла клинические испытания в Гамбии и Южной Африке, а 11-валентная вакцина (11-PCV) проходит испытания на Филиппинах.
Исследования эффективности полисахаридной вакцины в профилактике ОРИ или ушных инфекций у детей в промышленно развитых странах показали противоречивые результаты. В то время как некоторые исследования этой вакцины не показывают значительной эффективности (Douglas and Miles 1984; Sloyer, Ploussard and Howie 1981), исследования из Финляндии показывают в целом защитный эффект против серотипов, содержащихся в 14-PSV (Douglas and Miles 1984; Karma and другие 1980; Макела и другие 1980). Эффективность была более выражена у детей старше двух лет, чем у детей младшего возраста.Единственные исследования, оценивающие действие полисахаридной вакцины на детей в развивающихся странах, — это серия из трех испытаний, проведенных в Папуа-Новой Гвинее (Douglas and Miles 1984; Lehmann and others 1991; Riley and others 1981; Riley, Lehmann, and Alpers 1991). . Анализ объединенных данных этих испытаний показал снижение смертности от LRI на 59 процентов среди детей до пяти лет на момент вакцинации и на 50 процентов среди детей до двух лет. На основании этих и других исследований исследователи пришли к выводу, что вакцина оказывает влияние на тяжелую пневмонию.Более высокая, чем ожидалось, эффективность в этих испытаниях была приписана большему вкладу более иммуногенных серотипов взрослых в пневмонию в Папуа-Новой Гвинее (Douglas and Miles 1984; Riley, Lehmann, and Alpers 1991). Из-за низкой иммуногенности антигенов в 23-PSV против преобладающих детских серотипов внимание теперь направлено на более иммуногенные конъюгированные вакцины (Mulholland 1998; Obaro 1998; Temple 1991).
Эффективность 7-PCV и 9-PCV была оценена на предмет эффективности против инвазивного пневмококкового заболевания в четырех испытаниях, которые продемонстрировали эффективность вакцины от 71.От 0 до 97,4 процента (от 58 до 65 процентов для ВИЧ-положительных детей, среди которых заболеваемость пневмококком в 40 раз выше, чем среди ВИЧ-отрицательных детей) (Black and others 2000; Cutts and others 2005; Klugman and others 2003; O ‘ Брайен и другие 2003).
В США 7-PCV был включен в плановую вакцинацию младенцев и детей в возрасте до двух лет в 2000 году. К 2001 году заболеваемость всеми инвазивными пневмококковыми заболеваниями в этой возрастной группе снизилась на 69 процентов, а заболевания, вызываемые включенными серотипами вакцины и родственных серотипов снизились на 78 процентов (Whitney and others 2003).Подобные сокращения были подтверждены в исследовании в северной Калифорнии (Black and others 2001). Наблюдалось небольшое увеличение частоты инвазивных заболеваний, вызванных серотипами пневмококков, не включенных в вакцину, но оно было недостаточно большим, чтобы компенсировать существенное снижение заболеваемости, вызванное вакциной. Исследования также обнаружили значительное снижение инвазивной пневмококковой инфекции в непривитых старших возрастных группах, особенно среди взрослых в возрасте от 20 до 39 лет и в возрасте 65 лет и старше, что позволяет предположить, что вакцинация маленьких детей оказала значительный эффект в обществе.Такое преимущество может иметь место даже там, где распространенность ВИЧ-инфекции среди взрослых высока, а пневмококковая инфекция может быть рецидивирующей и опасной для жизни.
Воздействие вакцины на пневмококковую пневмонию как таковое трудно определить из-за проблем, связанных с установлением бактериальной этиологии пневмонии. В трех исследованиях оценивали влияние вакцины на рентгенологическую пневмонию (независимо от этиологического агента) и показали снижение на 20,5-37,0% случаев пневмонии, подтвержденной рентгенологически (9.0 процентов для ВИЧ-инфицированных) (Black and others 2000; Cutts and others 2005; Klugman and others 2003).
Несколько полевых испытаний оценили эффективность PCV против ушной инфекции. Несмотря на то, что вакцина привела к значительному сокращению подтвержденного посевом пневмококка отита, чистого снижения ушной инфекции среди вакцинированных детей не наблюдалось, вероятно, из-за увеличения частоты отита, вызванного видами пневмококков, не охваченных вакциной, ЧАС.influenzae и Moraxella catarrhalis (Eskola and others 2001; Kilpi and others 2003). Однако испытание в северной Калифорнии показало, что вакцина обладает защитным действием против частых инфекций уха и снижает потребность в установке тимпаностомической трубки (Fireman and others 2003). Таким образом, вакцина от ушной инфекции может быть полезной в развивающихся странах с высокими показателями хронического отита и кондуктивной тугоухости, и ее следует оценивать с помощью клинических испытаний.
Самым заметным преимуществом вакцины для общественного здравоохранения в развивающихся странах будет очевидное снижение смертности.Хотя первичным результатом исследования в Гамбии изначально была детская смертность, она была изменена на радиологическую пневмонию. Тем не менее, испытание показало снижение смертности на 16 процентов (уровень достоверности 95 процентов, от 3 до 38). Это испытание проводилось в сельской местности на востоке Гамбии, где трудно обеспечить круглосуточную лечебную помощь, включая ведение больных. Это испытание демонстрирует, что иммунизация, проводимая в рамках аутрич-программ, принесет значительную пользу для здоровья и экономики таких групп населения.Еще одно исследование, оценивающее влияние 11-PCV на радиологическую пневмонию, продолжается на Филиппинах; результаты ожидаются во второй половине 2005 года.
Ведение пациентов
Упрощение и систематизация ведения пациентов для ранней диагностики и лечения ОРИ позволили значительно снизить смертность в развивающихся странах, где доступ к педиатрам ограничен. В клинических рекомендациях ВОЗ по ведению случаев ОРИ (ВОЗ, 1991) используются два ключевых клинических признака: частота дыхания, , чтобы отличить детей с пневмонией от детей без, и втягивание нижней грудной стенки, , чтобы определить тяжелую пневмонию, требующую направления и госпитализации.Детям со слышимым стридором в спокойном и спокойном состоянии или такими опасными признаками тяжелого заболевания, как неспособность есть, также требуется направление. Дети без этих признаков классифицируются как страдающие ОРИ, но не пневмонией. Детей, у которых наблюдается только учащенное дыхание, лечат пневмонию амбулаторно. Детей, которые кашляют более 30 дней, направляют для дальнейшего обследования на туберкулез и другие хронические инфекции.
Диагностика пневмонии на основе учащенного дыхания
Первоначальные рекомендации по выявлению пневмонии на основе учащенного дыхания были разработаны в Папуа-Новой Гвинее в 1970-х годах.В исследовании 200 последовательных педиатрических пациентов и 50 последовательных госпитализаций (Shann, Hart, and Thomas 1984) 72 процента детей со слышимым хрипом в легких имели частоту дыхания 50 или более вдохов в минуту, тогда как только 19 процентов детей без потрескивания дышал с такой стремительной скоростью. Поэтому в первоначальных рекомендациях ВОЗ использовался порог в 50 вдохов в минуту, при достижении которого кашель у ребенка считался пневмонией.
Основное беспокойство вызывает относительно низкая чувствительность этого подхода, который может упустить от 25 до 40 процентов случаев пневмонии.Исследование в Веллоре, Индия, показало, что чувствительность можно улучшить, снизив порог до 40 для детей в возрасте от 1 до 4 лет, сохранив порог в 50 вдохов в минуту для младенцев в возрасте от 2 до 11 месяцев (Cherian and others 1988). Последующие исследования показали, что при использовании этих пороговых значений чувствительность улучшилась с 62 до 79 процентов на Филиппинах и с 65 до 77 процентов в Свазиленде, но в то же время специфичность упала с 92 до 77 процентов на Филиппинах и с 92 до 80 процентов. процентов в Свазиленде (Mulholland и др., 1992).На основе этих и других данных (Кэмпбелл, Байасс и др., 1989; Колстад и др., 1997; Перкинс и др., 1997; Редд, 1994; Симоес и др., 1997; Вебер и др., 1997) ВОЗ рекомендует ограничить частоту дыхания на 50 вдохов. в минуту для детей в возрасте от 2 до 11 месяцев и 40 вдохов в минуту для детей в возрасте от 12 месяцев до 5 лет.
Учащенное дыхание, по определению ВОЗ, выявляет около 85 процентов детей с пневмонией, и более 80 процентов детей с потенциально смертельной пневмонией, вероятно, успешно выявляются и лечатся с использованием диагностических критериев ВОЗ.Было показано, что лечение детей с учащенным дыханием антибиотиками снижает смертность (Sazawal and Black 2003). Проблема низкой специфичности критерия учащенного дыхания заключается в том, что от 70 до 80 процентов детей, которые могут не нуждаться в антибиотиках, получат их. Тем не менее, для работников первичной медико-санитарной помощи, для которых важна простота диагностики, учащенное дыхание, несомненно, является наиболее полезным клиническим признаком.
Диагноз пневмонии на основании втягивания грудной стенки
Дети поступают в больницу с тяжелой пневмонией, когда медицинские работники считают, что необходимы кислородные или парентеральные антибиотики (антибиотики, вводимые не перорально), или когда они не уверены в способности матери справиться .Обоснование парентеральных антибиотиков состоит в том, чтобы достичь более высоких уровней антибиотиков и преодолеть опасения по поводу абсорбции пероральных препаратов у больных детей.
В исследовании Папуа-Новой Гвинеи (Shann, Hart, and Thomas 1984) втягивание грудной клетки использовалось в качестве основного показателя тяжести, но исследования, проведенные в разных частях мира, показывают большие различия в темпах втягивания из-за различных определений. Ограничение этого термина втягиванием нижней грудной стенки, определяемым как движение внутрь костных структур грудной стенки с вдохом, предоставило лучший индикатор тяжести пневмонии, который можно научить медработникам.Он более специфичен, чем втяжение межреберных промежутков, которое часто встречается при бронхиолите.
В исследовании, проведенном в Гамбии (Кэмпбелл, Байасс и др., 1989), когорта из 500 детей от рождения до четырех лет посещалась дома еженедельно в течение одного года. За это время в клинику было направлено 222 эпизода LRI (учащенное дыхание, любое втягивание грудной стенки, расширение носа, свистящее дыхание, стридор или признаки опасности). Втяжение грудной клетки имело место в 62 процентах этих случаев, во многих случаях втягивание межреберных мышц.Если бы всех детей с каким-либо втягиванием грудной клетки госпитализировали, их количество превысило бы количество детских стационаров.
Исследования, проведенные на Филиппинах и в Свазиленде (Mulholland и др., 1992), показали, что втягивание нижней грудной стенки было более специфичным, чем втягивание межреберья, для диагностики тяжелой пневмонии, требующей госпитализации. В исследовании Веллора (Cherian and others 1988) втягивание нижней грудной стенки правильно предсказало 79 процентов детей с LRI, которые были госпитализированы педиатром.
Варианты противомикробных препаратов для перорального лечения пневмонии
Выбор противомикробного препарата для лечения основан на хорошо известных данных о том, что большинство бактериальных пневмоний у детей вызывается S. pneumoniae или H. influenzae . Однократная инъекция бензатин-пенициллина, хотя и длится долго, не обеспечивает адекватных уровней пенициллина для уничтожения H. influenzae . У ВОЗ есть технические документы, помогающие оценить соответствующие факторы при выборе противомикробных препаратов первого и второго ряда и сравнения различных противомикробных препаратов в отношении их антибактериальной активности, эффективности лечения и токсичности (ВОЗ, 1990).
Возникновение устойчивости к противомикробным препаратам у S. pneumoniae и H. influenzae вызывает серьезную озабоченность. В некоторых условиях тесты in vitro показывают, что более 50 процентов респираторных изолятов обеих бактерий устойчивы к ко-тримоксазолу, а устойчивость к пенициллину к S. pneumoniae постепенно становится проблемой во всем мире.
При пневмонии, в отличие от менингита, устойчивость возбудителя in vitro не всегда приводит к неэффективности лечения.Сообщения из Испании и Южной Африки предполагают, что пневмонию, вызванную устойчивым к пенициллину S. pneumoniae , можно успешно лечить с помощью достаточно высоких доз пенициллина. Амоксициллин концентрируется в тканях и макрофагах, и уровни препарата напрямую зависят от пероральных дозировок. Поэтому для успешного лечения ушных инфекций, вызванных устойчивым к пенициллину S. pneumoniae , в настоящее время используются более высокие дозы, чем в прошлом, — назначаемые дважды в день. Амоксициллин явно лучше пенициллина при таких инфекциях.Ситуация с ко-тримоксазолом менее ясна (Strauss and others 1998), и перед лицом высоких показателей устойчивости к ко-тримоксазолу амоксициллин может быть лучше для детей с тяжелой пневмонией.
Внутримышечные антибиотики для лечения тяжелой пневмонии
Несмотря на то, что хлорамфеникол активен против S. pneumoniae и H. influenzae, его пероральное всасывание у чрезвычайно больных детей нестабильно. Таким образом, рекомендации ВОЗ рекомендуют вводить хлорамфеникол внутримышечно в половине суточной дозы до срочного направления пациентов с тяжелой пневмонией.Дополнительным объяснением является то, что у крайне больных детей может быть сепсис или менингит, которые трудно исключить, и их необходимо немедленно лечить. Хотя внутривенный хлорамфеникол превосходит внутримышечный хлорамфеникол, процедура может отсрочить срочно необходимое лечение и увеличивает его стоимость.
Исследователи поставили под сомнение адекватность и безопасность внутримышечного хлорамфеникола. Хотя ранние исследования показали, что уровни взрослого в крови после внутримышечного введения были значительно ниже, чем после внутривенного введения, внутримышечный путь введения получил широкое признание после клинических отчетов, которые подтвердили его эффективность.Местные осложнения при внутримышечном введении сукцината левомицетина возникают редко, в отличие от более ранних внутримышечных препаратов. Хотя беспокойство по поводу апластической анемии после приема хлорамфеникола является обычным явлением, это осложнение крайне редко встречается у маленьких детей. Нет никаких доказательств того, что сукцинат хлорамфеникола внутримышечно вызывает побочные эффекты с большей вероятностью, чем другие формы и пути введения хлорамфеникола.
Диагностика гипоксемии на основе критериев ВОЗ
Стратегии ведения случаев ОРИ и комплексного ведения болезней грудного и детского возраста (ИВБДВ) зависят от точного направления больных детей в больницу и правильного стационарного лечения ИРН с применением кислорода или антибиотиков.Гипоксемия (дефицит кислорода в крови) у детей с LRI является хорошим предиктором смертности, коэффициент летальности в 1,2-4,6 раза выше при гипоксемическом LRI, чем при негипоксемическом LRI (Duke, Mgone, and Frank 2001; Onyango and others 1993). ), а кислород снижает смертность. Таким образом, важно как можно раньше выявлять гипоксемию у детей с LRI, чтобы предотвратить смерть. Хотя диагноз острой LRIs очень легко устанавливается путем распознавания тахипноэ, и хотя тяжелая LRI связана с втягиванием грудной стенки, клиническое распознавание гипоксемии более проблематично.Были изучены различные наборы клинических правил для прогнозирования наличия гипоксемии у детей с LRI (Cherian и др., 1988; Onyango и др., 1993; Usen и др., 1999). Хотя некоторые клинические инструменты обладают высокой чувствительностью для выявления гипоксемии, большое количество детей с гипоксемией все же будет пропущено при использовании этих критериев. Пульсоксиметрия — лучший инструмент для быстрого выявления гипоксемии у больных детей. Однако пульсоксиметры дороги и требуют периодических затрат на замену датчиков, по которым они недоступны в большинстве районных или даже специализированных больниц в развивающихся странах.
Руководство по лечению
Текущие рекомендации включают прием ко-тримоксазола два раза в день в течение пяти дней при пневмонии и внутримышечный пенициллин или хлорамфеникол для детей с тяжелой пневмонией. Проблемы повышения устойчивости к ко-тримоксазолу и ненужные направления детей с втягиванием грудной стенки привели к исследованиям, в которых изучаются альтернативы антибиотикам, которые в настоящее время используются при лечении ОРИ. Одно исследование показало, что амоксициллин и котримоксазол одинаково эффективны при нетяжелой пневмонии (Catchup Study Group 2002), хотя амоксициллин стоит в два раза дороже, чем котримоксазол.Что касается продолжительности лечения антибиотиками, исследования в Бангладеш, Индии и Индонезии показывают, что трехдневный пероральный прием котримоксазола или амоксициллина так же эффективен, как пять дней приема любого из препаратов у детей с нетяжелой пневмонией (Agarwal and others 2004; Kartasasmita 2003). ). В многоцентровом исследовании пенициллина, вводимого внутримышечно, и перорального амоксициллина у детей с тяжелой пневмонией, Аддо-Йобо и другие (2004) обнаружили схожие показатели излечения. Поскольку пациенты получали кислород при необходимости от гипоксемии и были переведены на другие антибиотики в случае неудачи, этот режим не подходит для лечения тяжелой пневмонии в амбулаторных условиях.
ВОЗ рекомендует назначать кислород, если он имеется в достаточном количестве, детям с признаками и симптомами тяжелой пневмонии и, если подача ограничена, детям с любым из следующих признаков: неспособность есть и пить, цианоз, частота дыхания выше или равный 70 вдохам в минуту, или серьезное втягивание грудной стенки (ВОЗ, 1993). Кислород следует вводить со скоростью 0,5 литра в минуту для детей младше 2 месяцев и 1 литр в минуту для детей старшего возраста. Поскольку кислород стоит дорого и его не хватает, особенно в отдаленных сельских районах развивающихся стран, ВОЗ рекомендует простые клинические признаки для выявления и лечения гипоксемии.Несмотря на эти рекомендации, исследование 21 учреждения первого уровня и районной больницы в семи развивающихся странах показало, что более 50 процентов госпитализированных детей с LRI неправильно лечились антибиотиками или кислородом (Nolan and others 2001), а в некоторых случаях кислород был недостаточным. в дефиците. Очевидно, что обеспечение кислородом младенцев с гипоксемией спасает жизнь, хотя никаких рандомизированных испытаний, подтверждающих это, не проводилось.
Профилактика и лечение пневмонии у ВИЧ-позитивных детей
Текущие рекомендации группы ВОЗ по ведению пневмонии у ВИЧ-позитивных детей и профилактике Pneumocystis jiroveci следующие (ВОЗ 2003):
Нетяжелая пневмония в возрасте до 5 лет. Пероральный котримоксазол должен оставаться антибиотиком первой линии, но следует использовать пероральный амоксициллин, если он доступен по цене или если ребенок проходил профилактику котримоксазолом.
Тяжелая или очень тяжелая пневмония. Нормальные руководящие принципы ВОЗ по ведению больных следует использовать для детей в возрасте до 2 месяцев. Детям от 2 до 11 месяцев рекомендуются инъекционные антибиотики и лечение пневмонии Pneumocystis jiroveci , а также начинается профилактика пневмонии Pneumocystis jiroveci после выздоровления.Для детей в возрасте от 12 до 59 месяцев лечение состоит из инъекционных антибиотиков и терапии пневмонии Pneumocystis jiroveci . Pneumocystis jiroveci Профилактика пневмонии должна проводиться в течение 15 месяцев детям, рожденным от ВИЧ-инфицированных матерей; однако эта рекомендация редко выполнялась.
Рентабельность вмешательств
Пневмония является причиной примерно пятой части из примерно 10,6 миллиона случаев смерти детей в возрасте до пяти лет в год.Там, где первичная медико-санитарная помощь является слабой, сокращение смертности с помощью мер общественного здравоохранения является приоритетной задачей. Как отмечалось ранее, доступные вмешательства — это первичная профилактика путем вакцинации и вторичная профилактика путем раннего выявления и ведения случаев заболевания.
Рентабельность вакцин против Hib обсуждается в главе 20. Мы не пытались анализировать рентабельность пневмококковых вакцин, потому что глобальные и региональные оценки бремени пневмококковой пневмонии в настоящее время разрабатываются и будут доступны только после позже в 2005 году.Кроме того, текущие цены на вакцины относительно стабильны в развитых странах, но ожидается, что цены для стран с низким и средним уровнем доходов будут значительно ниже, если вакцины закупаются на глобальном тендере.
Мы оцениваем стратегии вмешательства по ведению случаев LRIs у детей в возрасте до пяти лет. Медицинские работники, которые внедряют ведение пациентов, диагностируют LRI на основании учащенного дыхания, втягивания нижней грудной стенки или отдельных признаков опасности у детей с респираторными симптомами.Поскольку этот метод не делает различий между пневмонией и бронхиолитом, а также между бактериальной и вирусной пневмонией, мы группируем эти состояния в общую категорию «клиническая пневмония» (Rudan and others 2004). Этот подход предполагает, что большая часть клинической пневмонии имеет бактериальное происхождение и что медицинские работники могут значительно снизить летальность посредством диагностики частоты дыхания и своевременного приема антибиотиков (Sazawal and Black 2003). Мы рассчитали затраты на лечение по регионам Всемирного банка, используя стандартизованные исходные затраты, предоставленные редакторами томов, и затраты, опубликованные в Международном справочнике по индикаторам цен на лекарства (Management Sciences for Health 2005) и другой литературе ().В анализе рассматриваются четыре категории ведения больных, которые различаются тяжестью инфекции и точкой лечения:
Таблица 25.1
Входные данные для ведения случаев пневмонии в странах с низким и средним уровнем доходов.
нетяжелая пневмония, лечение в больнице
нетяжелая пневмония, лечение в медицинском учреждении
тяжелая пневмония, лечение в больнице
очень тяжелая пневмония, лечение в больнице.
Информация об этих категориях ведения пациентов и их результатах взята из отчета о методологии и предположениях, использованных для оценки затрат на расширение масштабов отдельных медицинских вмешательств, направленных на детей (ВОЗ и Здоровье детей-подростков, готовится к печати). Мы предположили, что для каждого пациента, которого лечит местный медицинский работник, в общей сложности будет три контрольных визита, а не повторные осмотры два раза в день в течение 10 дней, рекомендованные в отчете. Мы также предположили, что все пациенты с тяжелой пневмонией проходят рентгенологическое обследование, а не только 20 процентов, как это предлагается в отчете.Более того, мы приняли пятичасовой рабочий день для общинного медработника, минимальный рабочий день, необходимый для общинных медицинских работников в рамках инициативы «Здоровье и выживание детей» Агентства США по международному развитию (Bhattacharyya and others 2001).
представляет региональные оценки средних затрат на лечение на эпизод для четырех стратегий ведения случая. Поскольку мы считали, что цены на торгуемые товары, такие как лекарства и кислород, постоянны в разных регионах, региональные различия были вызваны различиями в расходах на больницы и медицинских работников.Латинская Америка и Карибский бассейн, Ближний Восток и Северная Африка имели самые высокие затраты на лечение.
Таблица 25.2
Средние затраты на лечение за один эпизод вмешательств по ведению пациентов с острой респираторной инфекцией нижних дыхательных путей (2001 долл. США).
Мы рассчитали региональные коэффициенты экономической эффективности (ССВ) для модельной численности населения в 1 миллион человек в каждом регионе, следуя стандартизированным руководящим принципам для экономического анализа (подробности см. В главе 15). Входные переменные включали стоимость лечения, подробно описанную в и, региональные показатели заболеваемости LRI, адаптированные из материалов Рудана и других (готовится к публикации), региональные показатели смертности и возрастные структуры, предоставленные редакторами томов, а также соотношение городского и сельского населения по регионам (World Банк 2002).Регион Европы и Центральной Азии был исключен из этого анализа из-за отсутствия информации о заболеваемости. В связи с отсутствием информации по регионам, мы предположили, что уровни эффективности вмешательства будут одинаковыми.
Количество лет жизни с поправкой на инвалидность можно предотвратить за счет сокращения продолжительности болезни и снижения смертности с помощью лечения. Мы предположили, что средняя продолжительность болезни составляет 8,5 дней для тех, кто не лечился, и 6,0 дней для тех, кто лечился. Мы использовали снижение летальности на 36,0% за счет лечения (Sazawal and Black 2003) и специфичность диагноза 78.5 процентов для пациентов, которым поставлен диагноз только на основании частоты дыхания. Вес нетрудоспособности одновременно с инфекцией составил 0,28. Мы не рассматривали инвалидность, вызванную хроническими последствиями LRI, потому что неясно, вызывает ли LRI в детстве долгосрочное нарушение функции легких или дети, у которых развивается нарушение функции легких, более склонны к инфекции (von Mutius 2001).
Поскольку один год этих вмешательств дает только одновременные выгоды — поскольку эффективно пролеченные люди не обязательно доживают до ожидаемой продолжительности жизни, учитывая, что они, вероятно, снова заразятся в следующем году, — мы рассчитали рентабельность пятилетнего вмешательства .Этот период времени позволил нам рассмотреть случай, когда целая когорта новорожденных и детей в возрасте от четырех лет избежала смертности от клинической пневмонии в раннем детстве благодаря вмешательству и получила преимущество, дожившее до ожидаемой продолжительности жизни. Наконец, в этом анализе учитывались только долгосрочные предельные затраты, которые варьируются в зависимости от количества пациентов, прошедших лечение, и не учитывались постоянные затраты на запуск программы, которых в настоящее время не существует.
представляет ССВ для конкретных регионов четырех категорий ведения случаев, а также ССВ для предоставления всех четырех категорий населению в 1 миллион человек.Во всех странах с низким и средним уровнем доходов лечение нетяжелой клинической пневмонии было более рентабельным на уровне учреждения, чем на уровне общины, и из всех четырех категорий ведения случая лечение очень тяжелой клинической пневмонии на уровне больниц было более эффективным. наименее рентабельный. Лечение нетяжелой клинической пневмонии на уровне учреждения было более рентабельным, чем лечение общинным работником здравоохранения, из-за более низкой стоимости одного посещения медицинского учреждения, чем многократных посещений медицинского работника.CER предоставления всех уровней лечения для всех стран с низким и средним уровнем доходов оценивается в 398 долларов США на год жизни с поправкой на инвалидность.
Таблица 25.3
ССВ вмешательств по ведению пациентов с пневмонией (2001 долл. США / год жизни с поправкой на инвалидность).
Поскольку мы предположили, что показатели эффективности были постоянными, региональные различия в CER для каждой категории ведения случая были связаны только с вариациями затрат на вмешательство, а относительные рейтинги экономической эффективности для стратегий были одинаковыми для всех регионов.Различия в ССВ для оказания всех категорий медицинской помощи также были обусловлены региональным соотношением городского и сельского населения. Мы предположили, что все пациенты в городских районах обращаются за лечением на уровне учреждения или выше, тогда как 80 процентов нетяжелых пациентов в сельской местности получают лечение на уровне сообщества, а остальные обращаются за лечением на уровне учреждения.
Внедрение стратегий борьбы с ОРИ: уроки опыта
Уроки стратегий профилактики и контроля ОРИ, реализованные в рамках национальных программ, включают стратегии вакцинации и ведения больных, описанные ниже.
Вакцины. Стратегии
Вакцина против Hib была включена в календарь плановой иммунизации младенцев в Северной Америке и Западной Европе в начале 1990-х годов. С созданием Глобального альянса по вакцинам и иммунизации (ГАВИ) и Фонда вакцин был достигнут прогресс в их внедрении в развивающихся странах, хотя серьезные препятствия остаются. К 2002 г. только 84 из 193 стран-членов ВОЗ ввели вакцину против Hib. С тех пор пять стран получили одобрение ГАВИ на поддержку внедрения вакцины против Hib в 2004–2005 годах.
Соединенные Штаты добавили 7-PCV в программу иммунизации младенцев в 2000 году. Некоторые другие промышленно развитые страны планируют включить вакцину в свои национальные программы иммунизации в 2005 году, тогда как другие рекомендуют использовать вакцину только в отдельных группах высокого риска. . В некоторых из этих последних стран определение высокого риска является довольно широким и включает значительную долю всех младенцев. В лицензированном в настоящее время 7-PCV отсутствуют определенные серотипы, важные для развивающихся стран, но 9-PCV и 11-PCV охватывают почти 80 процентов серотипов, вызывающих серьезные заболевания во всем мире.
Несмотря на успех вакцины против Hib в промышленно развитых странах и общепризнанное значение LRI как причины детской смертности, в результате действия ряда взаимосвязанных факторов внедрение вакцины в развивающихся странах было медленным. Устойчивое использование вакцины находится под угрозой в нескольких странах, которые ввели вакцину. Во-первых, масштабы заболеваний и смертей, вызванных Hib, не признаются в этих странах, отчасти из-за недостаточного использования бактериологической диагностики (в результате нехватки оборудования и ресурсов).Во-вторых, поскольку охват, достигнутый с помощью традиционных расширенных программ иммунизации вакцинами, остается низким во многих странах, добавление дополнительных вакцин не было определено в качестве приоритета. В-третьих, развивающиеся страны не предпринимали усилий по установлению полезности вакцины до тех пор, пока вакцина не была лицензирована и не использовалась регулярно в течение нескольких лет в промышленно развитых странах. Следовательно, вакцинация против Hib воспринималась как средство вмешательства для богатых стран. В результате всех этих факторов фактический спрос на вакцину оставался низким, даже когда поддержка предоставлялась через ГАВИ и Фонд вакцин.
В 2004 году правление ГАВИ поручило целевой группе по Hib изучить, как лучше всего поддержать национальные усилия по принятию основанных на фактических данных решений о внедрении вакцины против Hib. На основе рекомендаций целевой группы правление ГАВИ одобрило создание Инициативы против Hib для поддержки тех стран, которые желают либо продолжить вакцинацию против Hib, либо изучить вопрос о том, должно ли внедрение вакцины против Hib быть приоритетом для их систем здравоохранения. Консорциум, состоящий из Школы общественного здравоохранения Блумберга Джонса Хопкинса, Лондонской школы гигиены и тропической медицины, Центров по контролю и профилактике заболеваний и ВОЗ, был выбран для руководства этими усилиями.
Стратегии ведения случаев
Метаанализ исследований Сазавала и Блэка (Sazawal and Black, 2003) на уровне сообществ, посвященных стратегии ведения случаев ОРИ, включает 10 исследований, в которых оценивалось ее влияние на смертность, 7 с одновременной контрольной группой. Метаанализ показал снижение смертности от всех причин на 27 процентов среди новорожденных, на 20 процентов среди младенцев и на 24 процента среди детей в возрасте от одного до четырех лет. Смертность от LRI снизилась на 42, 36 и 36 процентов соответственно. Эти данные ясно показывают, что относительно упрощенное, но стандартизованное ведение случаев ОРИ может иметь значительное влияние на смертность не только от пневмонии, но и от других причин у детей от рождения до четырех лет.В настоящее время стратегия ведения пациентов с ОРИ включена в стратегию ИВБДВ, которая в настоящее время применяется более чем в 80 странах (см. Главу 63).
Несмотря на то, что каждый год из-за пневмонии гибнет огромное количество людей, обещания, заложенные в упрощенном ведении больных, не были успешно реализованы во всем мире. Одна из основных причин — недостаточное использование медицинских учреждений в странах или сообществах, в которых многие дети умирают от ОРИ. В Бангладеш, например, 92 процента больных детей не попадают в соответствующие медицинские учреждения (ВОЗ, 2002 г.).В Боливии 62 процента умерших детей не были доставлены к врачу в случае болезни (Aguilar and others 1998). В Гвинее 61 процент умерших больных детей не были доставлены к врачу (Schumacher and others 2002). Исследование Шелленберга и других (2003), проведенное в Танзании, показывает, что дети из более бедных семей реже получают антибиотики от пневмонии, чем дети из более обеспеченных семей, и что только 41 процент больных детей доставляют в медицинские учреждения.Таким образом, исследования неизменно подтверждают, что больные дети, особенно из бедных семей, не посещают медицинские учреждения.
Ряд стран разработали крупномасштабные и устойчивые программы лечения на уровне сообществ:
- В Гамбии действует национальная программа лечения пневмонии на уровне общин (ВОЗ 2004b).
- В районе Сиая в Кении неправительственная организация эффективно предоставляет медицинскими работниками лечение пневмонии и других детских болезней (ВОЗ, 2004b).
- В Гондурасе управление ОРИ было включено в Национальную интегрированную программу общинного ухода за детьми, в соответствии с которой добровольцы из местных сообществ проводят мониторинг роста, проводят санитарное просвещение и лечат пневмонию и диарею в более чем 1800 сообществах (ВОЗ 2004b).
В Бангладеш Комитет по развитию сельских районов Бангладеш и правительство внедрили программу борьбы с ОРИ, охватывающую 10 подокругов, с привлечением добровольцев из местных медицинских работников. Каждый работник отвечает за лечение детской пневмонии примерно в 100–120 домашних хозяйствах после трехдневной программы обучения.
- В Непале в 1986–89 гг. Общинная программа лечения ОРИ и диарейных заболеваний была протестирована в двух округах и показала существенное снижение смертности от LRI (Pandey and others 1989, 1991). В результате программа была интегрирована в службы здравоохранения Непала и реализуется в 17 из 75 округов страны женщинами-добровольцами, обученными выявлять и лечить пневмонию.
- В Пакистане в программе Lady Health Worker Program работает около 70 000 женщин, которые работают в общинах, обеспечивая образование и ведение детской пневмонии более чем 30 миллионам человек (ВОЗ 2004b).
Программа исследований и разработок
Программа исследований и разработок, изложенная ниже, суммирует приоритеты, установленные консультативными группами Инициативы по исследованиям вакцин (стратегии вмешательства в отношении вакцин) и Отдела ВОЗ по охране здоровья детей и подростков (случай — стратегии управления).
Стратегии вакцинации
Целевая группа ГАВИ по иммунизации против Hib дала ряд рекомендаций, которые различаются в зависимости от страны.Страны, внедрившие вакцину против Hib, должны сосредоточиться на документировании ее эффекта и должны использовать данные для информирования национальных органов власти, партнеров по развитию и других учреждений, занимающихся общественным здравоохранением, для обеспечения постоянной поддержки таких программ вакцинации. Страны, имеющие право на поддержку ГАВИ, которые еще не внедрили вакцины против Hib, часто сталкиваются с ограничениями из-за отсутствия местных данных и недостаточной осведомленности о региональных данных. Они могут решать эти вопросы на субрегиональных встречах, на которых страновые эксперты могут объединять данные и анализировать информацию из других стран.Кроме того, большинству стран необходимо проводить экономический анализ, основанный на стандартизированном инструменте. Наконец, всем странам, которые сталкиваются с высоким бременем Hib-инфекции, необходимо создать лабораторное оборудование, чтобы они могли определять заболеваемость Hib-менингитом в выбранных местах. Страны, в которых бремя болезни остается неясным, могут иметь ограниченные возможности для документирования случаев заболевания Hib с использованием протоколов, основанных на эпиднадзоре за инвазивным менингитом. Им необходимо будет изучить возможности использования альтернативных методов измерения бремени болезней, включая использование исследований вакцины.
Основываясь на опыте внедрения вакцин против Hib и гепатита B, ГАВИ проявил инициативу и в 2003 году на базе Школы общественного здравоохранения Джона Хопкинса в Балтиморе учредил инициативу по реализации программы ускоренной разработки и внедрения пневмококковых вакцин ( PneumoADIP; см. Http://www.preventpneumonia.org). Целью программы является установление и информирование о ценности пневмококковых вакцин и поддержка их доставки. Установление ценности вакцины требует разработки местных данных о бремени болезни и потенциальном воздействии вакцины на здоровье населения.Эти усилия могут быть достигнуты за счет усиленного эпиднадзора за болезнями и соответствующих клинических испытаний в выбранном количестве ведущих стран. После создания доказательная база будет передана лицам, принимающим решения, и ключевым лидерам общественного мнения, чтобы гарантировать принятие решений на основе данных. После того, как будет установлена рентабельность плановой вакцинации, необходимо будет создать системы доставки, и странам потребуется финансовая поддержка, чтобы вакцины могли быть включены в их программы иммунизации.Эти мероприятия инициируются до выпуска вакцин, предназначенных для использования в развивающихся странах, чтобы информировать о планировании потенциала, доступности продуктов и ценообразовании.
Стратегии ведения случаев
В 2003 г. Отдел здоровья детей и подростков ВОЗ созвал совещание для обзора данных и доказательств недавних исследований лечения ОРИ и предложения следующих изменений в руководящие принципы ведения случаев и приоритеты будущих исследований:
- Нетяжелая пневмония:
Повышение специфичности клинических диагностических критериев.
Пересмотреть текущие рекомендуемые ВОЗ критерии для выявления и лечения неудач лечения с учетом высоких показателей неудач терапии.
Проведите повторный анализ данных краткосрочных курсов терапии, чтобы лучше определить факторы, определяющие неэффективность лечения.
Провести плацебо-контролируемые испытания среди детей с хрипом и пневмонией в выбранных условиях с высокой распространенностью хрипов, чтобы определить, нуждаются ли такие дети в антибиотиках.
- Тяжелая пневмония. В рандомизированном клиническом исследовании в контролируемой среде Аддо-Йобо и другие (2004) показали, что пероральный амоксициллин так же эффективен, как парентеральный пенициллин или ампициллин; тем не менее, прежде чем его можно будет рекомендовать в целом, необходимо предпринять следующие действия:
Проанализировать данные об исключениях из исследования.
Определите предикторы, которые могут помочь отличить детей, нуждающихся в госпитализации и у которых впоследствии ухудшается состояние.
Переоценить текущие критерии неэффективности лечения, рекомендованные ВОЗ для тяжелой пневмонии, с учетом общих высоких показателей неэффективности терапии.
Провести описательные исследования в условиях общественного здравоохранения в нескольких центрах по всему миру, чтобы оценить клинические результаты перорального приема амоксициллина у детей в возрасте от 2 до 59 месяцев, у которых наблюдается втягивание нижней грудной стенки.
Задокументировать эффективность руководящих принципов ВОЗ по лечению детей с пневмонией и ВИЧ-инфекцией.
- LRI смертей:
Чтобы помочь разработать более эффективные меры по снижению смертности от LRI, подробно изучите эпидемиологию смертей от LRI в различных регионах, используя рутинные и современные лабораторные методы.
- Кислородная терапия:
Проведите исследования, чтобы показать эффективность кислорода для лечения тяжелых респираторных инфекций.
Соберите базовую информацию о наличии и доставке кислорода и его использовании в больницах в странах с низким уровнем дохода.
Изучите возможности пульсоксиметрии для оптимизации кислородной терапии в различных клинических условиях.
Провести исследования для улучшения специфичности клинических признаков при наложении признаков и симптомов малярии и пневмонии.
Изучите быстрые диагностические тесты на малярию, чтобы оценить их эффективность в различении малярии и пневмонии.
Изучить влияние широкого применения котримоксазола на устойчивость к сульфадоксин-пириметамину к Plasmodium falciparum .
Этиология: Данные об этиологии пневмонии у детей несколько устарели, и необходимы новые этиологические исследования, в которых используются современные технологии для идентификации патогенов.
Выводы: обещания и ловушки
Фактические данные ясно показывают, что подход ВОЗ к ведению больных и более широкое использование имеющихся вакцин снизят смертность от ОРИ среди детей младшего возраста от половины до двух третей. Само по себе систематическое применение упрощенного ведения больных, стоимость которого достаточно низка, чтобы быть доступным практически для любой развивающейся страны, снизит смертность от ОРИ как минимум на треть.Срочно нужно воплотить эту информацию в жизнь.
Стратегия ведения случая должна применяться и проспективно оцениваться, чтобы возникающие проблемы устойчивости к противомикробным препаратам, снижение эффективности текущего лечения рекомендованными противомикробными препаратами или появление неожиданных патогенов могли быть обнаружены на ранней стадии и чтобы можно было быстро принять меры по исправлению положения. Если действия медицинских работников на уровне сообществ будут дополнены внедрением стратегии ИВБДВ на всех уровнях первичной медико-санитарной помощи, то применение и оценка этой стратегии будет проще.Такая синергия также может помочь в сборе информации, которая поможет в дальнейшей точной настройке клинических признаков, чтобы даже сельские медицинские работники могли лучше отличить бронхиолит и хрипы от бактериальной пневмонии. Критике того, что меры по ведению пациентов могут привести к чрезмерному использованию противомикробных препаратов, следует противодействовать путем документального подтверждения их чрезмерного и неправильного использования врачами и другими медицинскими работниками. Хотя наблюдается возрождение интереса к проведению вмешательств на уровне сообществ, наш анализ показывает, что это может оказаться нерентабельным.В самом деле, ведение пациентов с ОРИ в учреждении первого уровня все еще может быть наиболее рентабельным в сочетании с более эффективными поведенческими вмешательствами при обращении за медицинской помощью.
Международное медицинское сообщество только начинает осознавать потенциальные преимущества вакцин против Hib и пневмококка. В настоящее время они дороги по сравнению с вакцинами Расширенной программы иммунизации, но цена вакцины Hib может упасть с выходом на рынок большего числа производителей в ближайшие несколько лет. Тем не менее, убедительные доказательства экономической эффективности вакцин необходимы для облегчения принятия национальных решений по внедрению вакцины и ее устойчивому использованию.В странах с низким уровнем дохода одних только положительных соотношений затрат и выгод и экономической эффективности оказывается недостаточно для включения этих вакцин в национальные программы иммунизации.
Ссылки
- Аддо-Йобо Э., Чисака Н., Хассан М., Хибберд П., Лозано Дж. М., Джина П. и др. Пероральный амоксициллин по сравнению с инъекционным пенициллином при тяжелой пневмонии у детей в возрасте от 3 до 59 месяцев: рандомизированное многоцентровое исследование эквивалентности. Ланцет. 2004. 364 (9440): 1141–48. [PubMed: 15451221]
- Адегбола Р.A., Falade A. G., Sam B. E., Aidoo M., Baldeh I., Hazlett D. et al. Этиология пневмонии у недоедающих и хорошо питающихся детей Гамбии. Журнал детских инфекционных болезней. 1994. 13 (11): 975–82. [PubMed: 7845751]
- Адегбола Р. А., Усен С. О., Вебер М., Ллойд-Эванс Н., Джоб К., Малхолланд К. и др. Haemophilus influenzae Менингит типа B в Гамбии после введения конъюгированной вакцины. Ланцет. 1999; 354 (9184): 1091–92. [PubMed: 10509502]
Агилар, А.М., Р. Альварадо, Д. Кордеро, П. Келли, А. Замора и Р. Сальгадо. 1998 г. Обследование смертности в Боливии: окончательный отчет — исследование и определение причин смерти детей в возрасте до пяти лет . Вена, Вирджиния: Базовая поддержка проекта институционализации выживания детей.
- Берман С. Средний отит у детей. Медицинский журнал Новой Англии. 1995a; 332 (23): 1560–65. [PubMed: 7739711]
- ———. 1995b Отит медиа в развивающихся странах, педиатрия 961, часть 1126–31. [PubMed: 7596700]
Бхаттачарья, К., П. Винч, К. ЛеБан и М. Тьен. 2001. «Стимулы и сдерживающие факторы для работников здравоохранения в сообществе: как они влияют на мотивацию, удержание и устойчивость». Basic Support for Institutionalizing Child Survival Project Агентства США по международному развитию, Арлингтон, Вирджиния.
- Блэк Р. Э., Моррис С. С., Брайс Дж. Где и почему 10 миллионов детей умирают каждый год? Ланцет. 2003. 361 (9376): 2226–34. [PubMed: 12842379]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Льюис Э., Рэй П., Хансен Дж. Р. Группа Центра изучения вакцин Kaiser Permanente Северной Калифорнии. Эффективность, безопасность и иммуногенность гептавалентной пневмококковой конъюгированной вакцины у детей. Журнал детских инфекционных болезней. 2000. 19 (3): 187–95. [PubMed: 10749457]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Хиатт Р. Безопасность, иммуногенность и эффективность олигосахаридного конъюгата у младенцев Haemophilus influenzae Вакцина типа B для населения США: возможные последствия для оптимального использования.Журнал инфекционных болезней. 1992; 165 (Приложение 43): S139–43. [PubMed: 1588149]
- Блэк С. Б., Шайнфилд Х. Р., Хансен Дж., Элвин Л., Лауфер Д., Малиноски Ф. Постлицензионная оценка эффективности семивалентной пневмококковой конъюгированной вакцины. Журнал детских инфекционных болезней. 2001. 20 (12): 1105–7. [PubMed: 11740313]
- Бобат Р., Кувадия Х. М., Мудли Д., Коутсудис А. Смертность в когорте детей, рожденных ВИЧ-инфицированными женщинами из Дурбана, Южная Африка. Южноафриканский медицинский журнал.1999. 89 (6): 646–48. [PubMed: 10443216]
- Booy R., Hodgson S., Carpenter L., Mayon-White R. T., Slack M. P., Macfarlane J. A. et al. Эффективность Haemophilus influenzae PRP-T конъюгированной вакцины типа B. Ланцет. 1994. 344 (8919): 362–66. [PubMed: 7 6]
- Брайс Дж., Боски-Пинто К., Сибуя К., Блэк Р. Э. Справочная группа ВОЗ по эпидемиологии здоровья детей. . Оценки ВОЗ причин смерти у детей. Ланцет. 2005; 365: 1147–52. [PubMed: 15794969]
- Кэмпбелл Х., Армстронг Дж. Р. М., Байасс П. Загрязнение воздуха в помещениях в развивающихся странах и острая респираторная инфекция у детей. Ланцет. 1989; 1 (8645): 1012. [PubMed: 2565480]
- Кэмпбелл Х., Байасс П., Ламонт А. С., Форги И. М., О’Нил К. П., Ллойд-Эанс Н., Гринвуд Б. М. Оценка клинических критериев для выявления тяжелых острых инфекций нижних дыхательных путей у детей. Ланцет. 1989; 1 (8633): 297–99. [PubMed: 2563457]
- Группа изучения догоняющих событий. Клиническая эффективность ко-тримоксазола по сравнению с амоксициллином дважды в день для лечения пневмонии: рандомизированное контролируемое клиническое испытание в Пакистане.Архив болезней детства. 2002; 86: 113–18. [Бесплатная статья PMC: PMC1761064] [PubMed: 11827905]
- Cherian T., John T. J., Simoes E. A., Steinhoff M. C., John M. Оценка простых клинических признаков для диагностики острой инфекции нижних дыхательных путей. Ланцет. 1988. 2: 125–28. [PubMed: 2899187]
- Cherian T., Simoes E. A., Steinhoff M. C., Chitra K., John M., Raghupathy P. et al. Бронхиолит в тропической южной Индии. Американский журнал болезней детей. 1990; 144 (9): 1026–30.[PubMed: 2396617]
- Каттс Ф. Т., Заман С. М. А., Энвере Г., Джаффар С., Левин О. С., Ококо Дж. Б. и др. Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное, двойное слепое, плацебо-контролируемое испытание. Ланцет. 2005; 365 (9465): 1139–46. [PubMed: 15794968]
- де Андраде А. Л., де Андраде Дж. Г., Мартелли К. М., Сильва С. А., де Оливейра Р. М., Коста М. С. и др. Эффективность конъюгированной вакцины Haemophilus influenzae B при детской пневмонии: исследование случай-контроль в Бразилии.Международный журнал эпидемиологии. 2004. 33 (1): 173–81. [PubMed: 15075166]
- Денни Ф. У. мл. Клиническое влияние респираторных вирусных инфекций человека. Американский журнал респираторной медицины и реанимации. 1995; 152 (4, часть 2): S4–12. [PubMed: 7551411]
- Dobson M. Концентраторы кислорода обеспечивают экономию средств для развивающихся стран: исследование, основанное на Новой Гвинее. Анестезия. 1991; 146: 217–19. [PubMed: 2014901]
- Дуглас Р. М., Майлз Х. Б. Вакцинация против Streptococcus pneumoniae в детстве: отсутствие очевидной пользы для маленьких австралийских детей.Журнал инфекционных болезней. 1984. 149 (6): 861–69. [PubMed: 6376653]
- Герцог Т., Мгоне Дж., Фрэнк Д. Гипоксемия у детей с тяжелой пневмонией в Папуа-Новой Гвинее. Международный журнал туберкулеза и болезней легких. 2001; 5: 511–19. [PubMed: 11409576]
- Эскола Дж., Кайхти Х., Такала А. К., Пелтола Х., Роннберг П. Р., Кела Э. и др. Рандомизированное проспективное полевое испытание конъюгированной вакцины для защиты младенцев и детей младшего возраста от инвазивной болезни Haemophilus influenzae типа B.Медицинский журнал Новой Англии. 1990. 323 (20): 1381–87. [PubMed: 2233904]
- Eskola J., Kilpi T., Palmu A., Jokinen J., Haapakoski J., Herva E. et al. Эффективность пневмококковой конъюгированной вакцины против острого среднего отита. Медицинский журнал Новой Англии. 2001. 344 (6): 403–409. [PubMed: 11172176]
- Фарли Дж., Кинг Дж. К., Наир П., Хайнс С. Э., Трессиер Р. Л., Винк П. Э. Инвазивное пневмококковое заболевание среди инфицированных и неинфицированных детей матерей с инфекцией, вызванной вирусом иммунодефицита человека.Журнал педиатрии. 1994; 124: 853–58. [PubMed: 8201466]
- Фиддиан-Грин Р. Г., Бейкер С. Нозокомиальная пневмония у критически больных: продукт аспирации или перемещения? Реанимационная медицина. 1991; 19: 763–69. [PubMed: 2055052]
- Файерман Б., Блэк С. Б., Шайнфилд Х. Р., Ли Дж., Льюис Э., Рэй П. Воздействие пневмококковой конъюгированной вакцины на средний отит. Журнал детских инфекционных болезней. 2003. 22 (1): 10–16. [PubMed: 12544402]
- Фритцелл Б., Плоткин С. Эффективность и безопасность вакцины, конъюгированной с капсульным полисахаридом столбняка и белком столбняка, Haemophilus influenzae.Журнал педиатрии. 1992. 121 (3): 355–62. [PubMed: 1517908]
- Гесснер Б. Д., Сутанто А., Линехан М., Джелантик И. Г., Флетчер Т., Герудуг И. К. и др. Заболеваемость гемофильной пневмонией и менингитом, предотвращаемым вакцинацией, Haemophilus Influenzae у индонезийских детей: рандомизированное исследование вакцины Hamlet. Ланцет. 2005; 365 (9453): 43–52. [PubMed: 15643700]
- Гафур А., Номани Н. К., Исхак З., Заиди С. З., Анвар Ф., Берни М. И. и др. Диагностика острых инфекций нижних дыхательных путей у детей в Равалпинди и Исламабаде, Пакистан.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S907–14. [PubMed: 2270413]
- Гилкс К. Ф. Пневмококковая болезнь и ВИЧ-инфекция. Анналы внутренней медицины. 1993; 118: 393–94. [PubMed: 8430986]
- Гоэль А., Бэмфорд Л., Хансло Д., Хасси Г. Первичная стафилококковая пневмония у детей раннего возраста: обзор 100 случаев. Журнал тропической педиатрии. 1999. 45 (4): 233–36. [PubMed: 10467836]
- Hament J. M., Aerts P. C., Fleer A., Van Dijk H., Harmsen T., Kimpen J. L., Wolfs T.F. Повышенная адгезия Streptococcus pneumoniae к эпителиальным клеткам человека, инфицированным респираторно-синцитиальным вирусом. Педиатрические исследования. 2004; 55 (6): 972–78. [PubMed: 15103015]
- Heath P. T. Haemophilus influenzae Конъюгированные вакцины типа B: обзор данных об эффективности. Журнал детских инфекционных болезней. 1998. 17 (9 доп.): S117–22. [PubMed: 9781743]
- Hortal M., Mogdasy C., Russi J. C., Deleon C., Suarez A. Микробные агенты, ассоциированные с пневмонией у детей из Уругвая.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S915–22. [PubMed: 2270414]
- Икеогу М. О., Вольф Б., Мате С. Легочные проявления у ВИЧ-серопозитивных и недоедающих детей в Зимбабве. Архив болезней детства. 1997. 76: 124–28. [Бесплатная статья PMC: PMC1717076] [PubMed:
- 01]
- Джина П. М., Кувадия Х. М., Кристал В. Pneumocystis carinii и cytomegalo Вирусные инфекции у тяжелобольных ВИЧ-инфицированных африканских младенцев. Анналы тропической педиатрии.1996; 16: 361–68. [PubMed: 8985536]
- Цзян З., Нагата Н., Молина Э., Бакалетз Л. О., Хокинс Х., Патель Дж. А. Усиленное прикрепление нетипируемого Haemophilus influenzae , инфицированного респираторно-синцитиальным вирусом, к респираторным эпителиальным клеткам, инфицированным синцитиальным вирусом. Инфекция и иммунитет. 1999; 67: 187–92. [Бесплатная статья PMC: PMC96295] [PubMed: 9864214]
Джон Т. Дж. 1994. «Кто определяет национальную политику здравоохранения?» In Вакцинация и здоровье в мире: четвертый ежегодный форум общественного здравоохранения Лондонской школы гигиены и тропической медицины , изд.Каттс Ф. Т., Смит П. Г., 205–11. Чичестер, Великобритания: Джон Вили.
- Джон Т. Дж., Чериан Т., Стейнхофф М. К., Симоэс Э. А., Джон М. Этиология острых респираторных инфекций у детей в тропиках на юге Индии. Обзоры инфекционных болезней. 1991; 13 (Приложение 6): S463–69. [PubMed: 1862277]
- Камат К. Р., Фельдман Р. А., Рао П. С., Уэбб Дж. К. Инфекция и болезнь в группе южноиндийских семей. Американский журнал эпидемиологии. 1969; 89: 375–83. [PubMed: 5778926]
- Карма П., Луотонен Дж., Тимонен М., Понтинен С., Пукандер Дж., Херва Э. и др. Эффективность пневмококковой вакцины против рецидивирующего среднего отита: предварительные результаты полевых испытаний в Финляндии. Annals of Otology, Rhinology, and Laryngology Suppl. 1980. 89 (3, часть 2): 357–62. [PubMed: 6778346]
Картасасмита, С. 2003. «Пероральный котримоксазол три или пять дней при нетяжелой пневмонии». Документ, представленный на Консультативном совещании Всемирной организации здравоохранения по обзору текущих исследований и лечению острых респираторных инфекций, Женева, 29 сентября — 1 октября.
- Килпи Т., Ахман Х., Йокинен Дж., Ланкинен К. С., Палму А., Саволайнен Х. и др. Защитная эффективность второй пневмококковой конъюгированной вакцины против пневмококкового острого среднего отита у младенцев и детей: рандомизированное контролируемое испытание семивалентной конъюгированной вакцины комплекса пневмококкового полисахарида и менингококкового белка внешней мембраны с 7-валентными соединениями у 1666 детей. Клинические инфекционные болезни. 2003. 37 (9): 1155–64. [PubMed: 14557958]
- Клугман К. П., Мадхи С. А., Хюбнер Р.E., Kohberger R., Mbelle N., Pierce N. et al. Испытание пневмококковой конъюгированной вакцины 9-Valent у детей с ВИЧ-инфекцией и без нее. Медицинский журнал Новой Англии. 2003. 349 (14): 1341–48. [PubMed: 14523142]
- Колстад П. Р., Бернем Г., Калтер Х. Д., Кения-Мугиша Н., Блэк Р. Э. Комплексное ведение детских болезней в Западной Уганде. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 77–85. [Бесплатная статья PMC: PMC2486998] [PubMed: 9529720]
- Lagos R., Хорвиц И., Торо Дж., Сан Мартин О., Абрего П., Бустаманте С. и др. Крупномасштабная, постлицензионная, селективная вакцинация чилийских младенцев конъюгированной вакциной PRP-T: практичность и эффективность в предотвращении инвазивных инфекций Haemophilus influenzae типа B. Журнал детских инфекционных болезней. 1996; 15: 216–22. [PubMed: 8852909]
- Леманн Д., Маршалл Т. Ф., Райли И. Д., Альперс М. П. Влияние пневмококковой вакцины на заболеваемость острыми инфекциями нижних дыхательных путей у детей Папуа-Новой Гвинеи.Анналы тропической педиатрии. 1991. 11 (3): 247–57. [PubMed: 1719924]
- Левин О. С., Лагос Р., Муньос А., Вильяроэль Дж., Альварес А. М., Абрего П. и др. Определение бремени пневмонии у детей, которую можно предотвратить с помощью вакцинации против Haemophilus influenzae Тип B. Журнал детских инфекционных болезней. 1999. 18 (12): 1060–64. [PubMed: 10608624]
- Лукас С. Б., Пикок С. С., Хунноу А., Браттегаард К., Коффи К., Хонд М. и др. Заболевание детей, инфицированных ВИЧ в Абиджане, Кот-д’Ивуар.Британский медицинский журнал. 1996; 312: 335–38. [Бесплатная статья PMC: PMC2350283] [PubMed: 8611829]
- Мадхи С.А., Петерсен К., Мадхи А., Хосал М., Клугман К.П. Повышенное бремя болезней и устойчивость бактерий к антибиотикам, вызывающая тяжелые инфекции нижних дыхательных путей, приобретенные в сообществе Дети, инфицированные вирусом иммунодефицита человека 1. Клинические инфекционные болезни. 2000. 31: 170–76. [PubMed: 10
- 7]
- Мадхи С. А., Петерсен К., Мадхи А., Васас А., Клугман К. П.Влияние вируса иммунодефицита человека типа 1 на спектр заболеваний Streptococcus pneumoniae у детей Южной Африки. Журнал детских инфекционных болезней. 2000. 19 (12): 1141–47. [PubMed: 11144373]
- Макела П. Х., Сибаков М., Херва Э., Хенрихсен Дж., Луотонен Дж., Тимонен М. и др. Пневмококковая вакцина и средний отит. Ланцет. 1980; 2 (8194): 547–51. [PubMed: 6106735]
Управленческие науки для здравоохранения. 2005. Международный справочник по индикаторам цен на лекарства .Кембридж, Массачусетс: Управленческие науки для здоровья.
- МакКуллерс Дж. А., Бартмесс К. С. Роль нейраминидазы в летальном синергизме между вирусом гриппа и Streptococcus pneumoniae . Журнал инфекционных болезней. 2003. 187: 1000–9. [PubMed: 12660947]
- Монто А. С., Ульман Б. М. Острое респираторное заболевание в американском сообществе: исследование Текумсе. Журнал Американской медицинской ассоциации. 1974. 227 (2): 164–69. [PubMed: 4357298]
- Малхолланд К., Усен С., Адегбола Р., Вебер Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998. 352 (9127): 575–76. [PubMed: 9716087]
- Малхолланд Э. К., Симоэс Э. А., Касталес М. О., МакГрат Э. Дж., Маналак Э. М., Гоув С. Стандартизированная диагностика пневмонии в развивающихся странах. Журнал детских инфекционных болезней. 1992; 11: 77–81. [PubMed: 1741202]
- Малхолланд К., Хилтон С., Адегбола Р., Усен С., Опарауго А., Омосиго С. и др. Рандомизированное исследование Haemophilus influenzae вакцины конъюгированной против столбняка с белком типа B для профилактики пневмонии и менингита у младенцев в Гамбии.Ланцет. 1997. 349 (9060): 1191–97. [PubMed:
- 39]
- Натху К. Дж., Нкрума Ф. К., Ндлову Д., Нхембе Д., Пири Дж., Ково Х. Острая инфекция нижних дыхательных путей у госпитализированных детей в Зимбабве. Анналы тропической педиатрии. 1993; 13: 253–61. [PubMed: 7505550]
- Нойзил К. М., Чжу Ю., Гриффин М. Р., Эдвардс К. М., Томпсон Дж. М., Толлефсон С. Дж., Райт П. Ф. Бремя межпандемического гриппа у детей младше 5 лет: 25-летнее перспективное исследование. Журнал инфекционных болезней.2002; 185: 147–52. [PubMed: 11807687]
- Nolan T., Angos P., Cunha A. J., Muhe L., Qazi S., Simoes E. A. et al. Качество стационарной помощи тяжелобольным детям в менее развитых странах. Ланцет. 2001. 357 (9250): 106–10. [PubMed: 11197397]
- Обаро С., Лич А., Макадам К. В. Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998; 352 (9127): 575. [PubMed: 9716086]
- О’Брайен К. Л., Моултон Л. Х., Рид Р., Уэзерхольц Р., Оски Дж., Браун Л. и др. Эффективность и безопасность семивалентной конъюгированной пневмококковой вакцины у детей американских индейцев: групповое рандомизированное исследование.Ланцет. 2003. 362 (9381): 355–61. [PubMed: 12 8]
- Оньянго Ф. Э., Стейнхофф М. К., Вафула Э. М., Вариуа С., Мусиа Дж., Китони Дж. Гипоксемия у маленьких кенийских детей с острой инфекцией нижних дыхательных путей. Британский медицинский журнал. 1993. 306 (6878): 612–15. [Бесплатная статья PMC: PMC1676956] [PubMed: 8369033]
- Пандей М. Р., Даулер Н. М., Старбак Э. С., Хьюстон Р. М., Макферсон К. Снижение общей смертности детей в возрасте до пяти лет в Западном Непале с помощью противомикробного лечения пневмонии на уровне местных сообществ.Ланцет. 1991. 338 (8773): 993–97. [PubMed: 1681351]
- Пандей М. Р., Шарма П. Р., Губхаджу Б. Б., Шакья Г. М., Неупане Р. П., Гаутам А. и др. Воздействие пилотной программы борьбы с острыми респираторными инфекциями (ОРИ) в сельском сообществе Горного региона Непала. Анналы тропической педиатрии. 1989. 9 (4): 212–20. [PubMed: 2482002]
- Педерсон Дж., Найроп М. Анестезиологическое оборудование для развивающихся стран. Британский журнал анестезии. 1991; 66: 264–70. [PubMed: 1817634]
- Пейрис Дж.S., Yu W. C., Leung C. W., Cheung C. Y., Ng W. F., Nicholls J. M. et al. Повторное появление заболевания подтипа H5N1 гриппа человека со смертельным исходом. Ланцет. 2004; 363 (9409): 617–19. [Бесплатная статья PMC: PMC7112424] [PubMed: 14987888]
- Перкинс Б. А., Цукер Дж. Р., Отинео Дж., Джафари Х. С., Пакстон Л., Редд С. С. и др. Оценка алгоритма интегрированного ведения детских болезней в районе Кении с высоким уровнем передачи малярии. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 33–42.[Бесплатная статья PMC: PMC2487004] [PubMed: 9529716]
Киамбао, Б. П., Э. А. Симоес, Э. Абучехо-Ладесма, Л. С. Гозум, С. П. Луписан, Л. Т. Сомбреро и П. Дж. Рууту (Консорциум ARIVAC). Скоро. «Серьезные детские инфекции, приобретенные в сообществе, в сельских районах Азии (остров Бохол, Филиппины)». Журнал детских инфекционных болезней .
Редд С. Диагностика и лечение острых респираторных инфекций в Лесото. Политика и управление здравоохранением. 1994; 5: 255–60.
- Райли И. Д., Эверингем Ф. А., Смит Д. Э., Дуглас Р. М. Иммунизация поливалентной пневмококковой вакциной: влияние респираторной смертности у детей, живущих в Высокогорье Новой Гвинеи. Архив болезней детства. 1981. 56 (5): 354–57. [Бесплатная статья PMC: PMC1627425] [PubMed: 7020609]
- Райли И. Д., Леманн Д., Альперс М. П. Испытания пневмококковой вакцины в Папуа-Новой Гвинее: взаимосвязь между эпидемиологией пневмококковой инфекции и эффективностью вакцины. Обзоры инфекционных болезней.1991; 13 (Приложение 6): S535–41. [PubMed: 1862283]
- Рудан И., Томаскович Л., Боски-Пинто К., Кэмпбелл Х. Справочная группа ВОЗ по эпидемиологии здоровья детей. Глобальная оценка заболеваемости клинической пневмонией среди детей в возрасте до пяти лет. Бюллетень Всемирной организации здравоохранения. 2004. 82 (12): 895–903. [Бесплатная статья PMC: PMC2623105] [PubMed: 15654403]
Рудан и другие. Скоро.
- Santosham M., Wolff M., Reid R., Hohenboken M., Bateman M., Goepp J.и другие. Эффективность конъюгированной вакцины, состоящей из Haemophilus influenzae типа B и Neisseria meningitidis Внешнемембранного белкового комплекса, у младенцев навахо. Медицинский журнал Новой Англии. 1991. 324 (25): 1767–72. [PubMed: 1
6]
- Сазавал С., Блэк Р. Е. Группа исследований по ведению больных с пневмонией: влияние ведения больных с пневмонией на смертность новорожденных, младенцев и детей дошкольного возраста — метаанализ испытаний на уровне сообществ. Ланцетные инфекционные болезни.2003; 3: 547–56. [PubMed: 12954560]
- Schellenberg J. A., Victora C.G., Mushi A., de Savigny D., Schellenberg D., Mshinda H. et al. Неравенство среди очень бедных: здравоохранение для детей в сельских районах Южной Танзании. Ланцет. 2003. 361 (9357): 561–66. [PubMed: 12598141]
- Шнайдер Г. Обеспечение кислородом в сельских районах Африки: личный опыт. Международный журнал туберкулеза и болезней легких. 2001. 5 (6): 524–26. [PubMed: 11409578]
Шумахер, Р., Э. Сведберг, М.О. Диалло, Д. Р. Кейта, Х. Кальтер, О. Паша. 2002. Исследование смертности в Гвинее: исследование причин смерти детей в возрасте до пяти лет . Арлингтон, Вирджиния: Спасите детей и базовая поддержка для институционализации проекта выживания детей.
- Шэнн Ф. Этиология тяжелой пневмонии у детей в развивающихся странах. Детская инфекционная болезнь. 1986. 5 (2): 247–52. [PubMed: 3952013]
- Шенн Ф., Граттен М., Гермер С., Линнеманн В., Хазлетт Д., Пейн Р. Этиология пневмонии у детей в больнице Горока, Папуа-Новая Гвинея.Ланцет. 1984; 2 (8402): 537–41. [PubMed: 6147602]
- Шэнн Ф., Харт К., Томас Д. Острые инфекции нижних дыхательных путей у детей: возможные критерии отбора пациентов для антибактериальной терапии и госпитализации. Бюллетень Всемирной организации здравоохранения. 1984; 62: 749–51. [Бесплатная статья PMC: PMC2536213] [PubMed: 6334573]
- Simoes E. A. Респираторно-синцитиальная вирусная инфекция. Ланцет. 1999. 354 (9181): 847–52. [PubMed: 10485741]
- Симоэс Э. А., Деста Т., Тессема Т., Gerbresellassie T., Dagnew M., Gove S. Эффективность медицинских работников после обучения комплексному ведению детских болезней в Гондэре, Эфиопия. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 43–53. [Бесплатная статья PMC: PMC2487005] [PubMed: 9529717]
- Слойер Дж. Л. Дж., Плуссард Дж. Х., Хоуи В. М. Эффективность пневмококковой полисахаридной вакцины в предотвращении острого среднего отита у младенцев в Хантсвилле, Алабама. Обзоры инфекционных болезней. 1981; 3 (Прил.): S119–23. [PubMed: 7280444]
- Стенсбаль Л.Г., Девасундарам Дж. К., Симоэс Э. А. Эпидемии респираторно-синцитиального вируса: взлеты и падения сезонного вируса. Журнал детских инфекционных болезней. 2003; 22 (2 доп.): S21–32. [PubMed: 12671449]
- Штраус В. Л., Кази С. А., Кунди З., Номани Н. К., Шварц Б. Группа по изучению ко-тримоксазола. Устойчивость к противомикробным препаратам и клиническая эффективность ко-тримоксазола по сравнению с амоксициллином при пневмонии у детей в Пакистане: рандомизированное контролируемое исследование. Ланцет. 1998. 352: 270–74. [PubMed: 96]
- Темпл К., Гринвуд Б., Инскип Х., Холл А., Коскела М., Лейнонен М. Ответ антител на пневмококковую капсульную полисахаридную вакцину у африканских детей. Журнал детских инфекционных болезней. 1991. 10 (5): 386–90. [PubMed: 2067888]
- Тупаси Т. Э., Лусеро М. Г., Магдангал Д. М., Мангубат Н. В., Сунико М. Э., Торрес К. У. и др. Этиология острой инфекции нижних дыхательных путей у детей из Алабанга, Метро Манила. Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S929–39. [PubMed: 2270415]
ЮНЭЙДС (Объединенная программа Организации Объединенных Наций по ВИЧ / СПИДу).2002. Обновление эпидемии СПИДа . Женева: ЮНЭЙДС.
- Усен С., Вебер М., Малхолланд К., Джаффар С., Опарауго А., Омосиго С. и др. Клинические предикторы гипоксемии у детей Гамбии с острой инфекцией нижних дыхательных путей: проспективное когортное исследование. Британский медицинский журнал. 1999. 318 (7176): 86–91. [Бесплатная статья PMC: PMC27680] [PubMed: 9880280]
- Van den Hoogen BG, de Jong JC, Groen J., Kuiken T., de Groot R., Fouchier RA, Osterhaus AD Недавно обнаруженный человеческий пневмовирус, выделенный у детей раннего возраста при заболевании дыхательных путей.Природная медицина. 2001; 7: 719–24. [Бесплатная статья PMC: PMC7095854] [PubMed: 11385510]
- Вуори-Холопайнен Э., Пелтола Х. Переоценка легочного легочного: обзор старого метода для лучшей этиологической диагностики детской пневмонии. Клинические инфекционные болезни. 2001. 32 (5): 715–26. [PubMed: 11229839]
- Вебер М. В., Малхолланд Э. К., Джаффар С., Трёдссон Х., Гоув С., Гринвуд Б. М. Оценка алгоритма комплексного ведения детских болезней в районе с сезонной малярией в Гамбии.Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 25–32. [Бесплатная статья PMC: PMC2486992] [PubMed: 9529715]
- Венгер Дж. Д., ДиФабио Дж., Ландаверде Дж. М., Левин О. С., Гаафар Т. Внедрение конъюгированных вакцин против Hib в непромышленно развитых странах: опыт в четырех странах, которые «недавно начали принимать» . Вакцина. 1999. 18 (78): 736–42. [PubMed: 10547434]
Wenger, J. D., and M. M. Levine, eds. 1997. Эпидемиологическое влияние конъюгированной вакцины на инвазивное заболевание, вызываемое гемофильной палочкой Haemophilus influenzae Тип B .Нью-Йорк: Марсель Деккер.
- Уитни К. Г., Фарли М. М., Хадлер Дж., Харрисон Л. Х., Беннет Н. М., Линфилд Р. и др. Снижение инвазивного пневмококкового заболевания после введения протеин-полисахаридной конъюгированной вакцины. Медицинский журнал Новой Англии. 2003. 348 (18): 1737–46. [PubMed: 12724479]
ВОЗ (Всемирная организация здравоохранения). 1990. «Антибиотики в лечении острых респираторных инфекций у детей раннего возраста». Неопубликованный документ WHO / ARI / 90.10, доступный по запросу в Отделе здоровья и развития детей, бывшего Отдела борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 1991. «Ведение маленького ребенка с острой респираторной инфекцией. Модуль обучения навыкам супервизии». Неопубликованный документ, доступный по запросу в Отделе здоровья и развития детей ВОЗ, бывшем Отделении борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 2002. Многострановая оценка эффективности, затрат и воздействия ИВБДВ (MCE): отчет о ходе работы, май 2001 г. — апрель 2002 г. .WHO / FCH / CAH / 02.16. Женева: Отдел здоровья и развития детей и подростков, ВОЗ.
———. 2003 г. Консультативное совещание по ведению детей с пневмонией и ВИЧ-инфекцией, 30–31 января 2003 г., Хараре, Зимбабве . WHO / FCH / CAH / 03.4. Женева: ВОЗ.
- ———. 2004a Группа по обзору Haemophilus influenzae Бремя болезни типа B (Hib) в Бангладеш, Индонезия и других азиатских странах, Бангкок, 28–29 января 2004 г. Еженедельный эпидемиологический отчет 79 (18): 173–75.[PubMed: 15168565]
———. 2004b. «Совместное заявление ВОЗ / ЮНИСЕФ: ведение пневмонии в общественных местах». WHO / FCH / CAG / 04.06. ВОЗ, Женева.
ВОЗ (Всемирная организация здравоохранения) и здоровье детей-подростков. Скоро. Отчет о методологии и предположениях, использованных для оценки затрат на расширение отдельных мероприятий по охране здоровья детей до 95% с целью снижения смертности детей в возрасте до пяти лет . Женева: ВОЗ.
- Уильямс Б. Г., Гоус Э., Боски-Пинто К., Брайс Дж., Дай С. Оценки глобального распределения детской смертности от острых респираторных инфекций. Ланцетные инфекционные болезни. 2002; 2: 25–32. [PubMed: 118]
Всемирный банк. 2002. Показатели мирового развития . CD-ROM. Вашингтон, округ Колумбия: Всемирный банк.
- Цви К. Дж., Петтифиор Дж. М., Содерлунд Н. Педиатрическая больница при городской региональной больнице Южной Африки: влияние ВИЧ, 1992–1997. Анналы тропической педиатрии. 1999; 19: 135–42. [PubMed: 106]
Острые респираторные инфекции у детей — приоритеты борьбы с заболеваниями в развивающихся странах
Острые респираторные инфекции (ОРИ) классифицируются как инфекции верхних дыхательных путей (URI) или инфекции нижних дыхательных путей (LRIs).Верхние дыхательные пути состоят из дыхательных путей от ноздрей до голосовых связок в гортани, включая придаточные пазухи носа и среднее ухо. Нижние дыхательные пути покрывают продолжение дыхательных путей от трахеи и бронхов к бронхиолам и альвеолам. ОРИ не ограничиваются дыхательными путями и имеют системные эффекты из-за возможного распространения инфекции или микробных токсинов, воспаления и снижения функции легких. Дифтерия, коклюш (коклюш) и корь — это болезни, которые можно предотвратить с помощью вакцин, которые могут иметь компонент дыхательных путей, но также влияют на другие системы; они обсуждаются в главе 20.
За исключением неонатального периода, ОРИ являются наиболее частой причиной как болезней, так и смертности у детей в возрасте до пяти лет, у которых в среднем от трех до шести эпизодов ОРИ ежегодно, независимо от того, где они живут или каково их экономическое положение (Kamath and others 1969; Монто и Ульман 1974). Тем не менее, соотношение легких и тяжелых заболеваний варьируется между странами с высоким и низким уровнем доходов, и из-за различий в конкретной этиологии и факторах риска тяжесть LRIs у детей в возрасте до пяти лет хуже в развивающихся странах, что приводит к более высокому уровню заболеваемости. летальность.Хотя медицинская помощь может до некоторой степени снизить как тяжесть заболевания, так и летальный исход, многие тяжелые формы LRI не поддаются лечению, в основном из-за отсутствия высокоэффективных противовирусных препаратов. Ежегодно умирает около 10,8 миллиона детей (Black, Morris, and Bryce, 2003). По оценкам, в 2000 году 1,9 миллиона из них умерли от ОРИ, 70 процентов из них — в Африке и Юго-Восточной Азии (Williams and others 2002). По оценкам Всемирной организации здравоохранения (ВОЗ), 2 миллиона детей в возрасте до пяти лет умирают от пневмонии ежегодно (Bryce and others 2005).
Причины ОРИ и бремя болезней
ОРИ у детей уносят тяжелый урон жизни, особенно там, где медицинская помощь недоступна или за ней не обращаются.
Инфекции верхних дыхательных путей
URI являются наиболее распространенными инфекционными заболеваниями. К ним относятся ринит (простуда), синусит, инфекции уха, острый фарингит или тонзиллофарингит, эпиглоттит и ларингит, из которых инфекции уха и фарингит вызывают более серьезные осложнения (глухота и острая ревматическая лихорадка соответственно).Подавляющее большинство URI имеют вирусную этиологию. Риновирусы составляют от 25 до 30 процентов URI; респираторно-синцитиальные вирусы (РСВ), вирусы парагриппа и гриппа, метапневмовирус человека и аденовирусы — от 25 до 35 процентов; вирусы короны на 10 процентов; и неопознанные вирусы для остальных (Denny 1995). Поскольку большинство URI являются самоограничивающимися, их осложнения более важны, чем инфекции. Острые вирусные инфекции предрасполагают детей к бактериальным инфекциям носовых пазух и среднего уха (Berman 1995a), а аспирация инфицированных секретов и клеток может приводить к LRIs.
Острый фарингит
Острый фарингит у детей младшего возраста более чем в 70% случаев вызывается вирусами. Типичны легкое покраснение глотки, отек и увеличение миндалин. Стрептококковая инфекция редко встречается у детей до пяти лет и более часто встречается у детей старшего возраста. В странах с многолюдными условиями жизни и группами населения, которые могут иметь генетическую предрасположенность, постстрептококковые последствия, такие как острый ревматизм и кардит, распространены у детей школьного возраста, но могут также возникать у детей младше пяти лет.Острый фарингит в сочетании с развитием перепонки в горле почти всегда вызывается в развивающихся странах Corynebacterium diphtheriae . Однако при почти повсеместной вакцинации младенцев вакциной АКДС (дифтерия-столбняк-коклюш) дифтерия встречается редко.
Острая ушная инфекция
Острая ушная инфекция встречается у 30 процентов URI. В развивающихся странах с неадекватной медицинской помощью это может привести к перфорации барабанных перепонок и хроническим выделениям из уха в более позднем детстве и, в конечном итоге, к ухудшению слуха или глухоте (Berman 1995b).Хроническая ушная инфекция после повторных эпизодов острой ушной инфекции распространена в развивающихся странах, поражая от 2 до 6 процентов детей школьного возраста. Связанная с этим потеря слуха может приводить к инвалидности и влиять на обучение. Повторные ушные инфекции могут привести к мастоидиту, который, в свою очередь, может распространить инфекцию на мозговые оболочки. Мастоидит и другие осложнения, вызванные ОРВИ, являются причиной почти 5 процентов всех смертей от ОРИ во всем мире (Williams и др., 2002).
Инфекции нижних дыхательных путей
Распространенными инфекциями нижних дыхательных путей у детей являются пневмония и бронхиолит.Частота дыхания является ценным клиническим признаком для диагностики острой ЛРН у кашляющих и учащенно дышащих детей. Наличие втягивания нижней грудной стенки указывает на более тяжелое заболевание (Mulholland и др., 1992; Shann, Hart, and Thomas 1984).
В настоящее время наиболее частыми причинами вирусных LRIs являются RSV. Они, как правило, очень сезонные, в отличие от вирусов парагриппа, следующей наиболее частой причины вирусных LRI. Эпидемиология вирусов гриппа у детей в развивающихся странах заслуживает срочного исследования, поскольку доступны безопасные и эффективные вакцины.До эффективного использования противокоревой вакцины вирус кори был самой важной вирусной причиной заболеваемости и смертности детей, связанных с респираторными путями, в развивающихся странах.
Пневмония
И бактерии, и вирусы могут вызывать пневмонию. Бактериальная пневмония часто вызывается Streptococcus pneumoniae (пневмококк) или Haemophilus influenzae, в основном типом b (Hib) и иногда Staphylococcus aureus или другими стрептококками.Всего от 8 до 12 из множества типов пневмококка вызывают большинство случаев бактериальной пневмонии, хотя конкретные типы могут различаться у взрослых и детей и в разных географических регионах. Другие патогены, такие как Mycoplasma pneumoniae и Chlamydia pneumoniae, , вызывают атипичные пневмонии. Их роль как причины тяжелых заболеваний у детей до пяти лет в развивающихся странах неясна.
Бремя LRIs, вызванного Hib или S. pneumoniae , трудно определить, поскольку современные методы установления бактериальной этиологии не обладают чувствительностью и специфичностью.Результаты посева из глотки не всегда позволяют выявить патоген, являющийся причиной LRI. Бактериальные культуры образцов аспирата легких часто считаются золотым стандартом, но они не подходят для применения в полевых условиях. Обзор нескольких исследований Вуори-Холопайнен и Пелтола (2001) показывает, что на S. pneumoniae и Hib приходится от 13 до 34 процентов и от 1,4 до 42,0 процентов бактериальных пневмоний, соответственно, тогда как исследования Адегбола и др. (1994), Шэнн, Граттен и другие (1984) и Уолл и другие (1986) предполагают, что Hib составляет от 5 до 11 процентов случаев пневмонии.
Пониженные уровни клинической или радиологической пневмонии при клинических испытаниях девятивалентной пневмококковой конъюгированной вакцины дают оценку бремени болезней, предупреждаемых с помощью вакцины ( валентность указывает количество серотипов, от которых вакцина обеспечивает защиту; конъюгат относится к конъюгации полисахаридов с белковым остовом). В исследовании, проведенном в Гамбии, было предотвращено 37 процентов радиологической пневмонии, что отражает количество заболеваний, вызванных S.pneumoniae, , а смертность снизилась на 16 процентов (Cutts and others 2005).
Колонизация верхних дыхательных путей потенциально патогенными организмами и аспирация зараженных секретов участвуют в патогенезе бактериальной пневмонии у детей младшего возраста. Было показано, что инфицирование верхних дыхательных путей вирусом гриппа или RSV увеличивает связывание как H. influenzae (Jiang и др., 1999), так и S. pneumoniae (Hament and others 2004; McCullers and Bartmess 2003) с подкладкой. клетки носоглотки.Это открытие может объяснить, почему рост пневмококковой пневмонии идет параллельно с эпидемиями гриппа и RSV. Исследование, проведенное в Южной Африке, показало, что вакцинация девятивалентной пневмококковой конъюгированной вакциной снижает заболеваемость вирус-ассоциированной пневмонией, вызывающей госпитализацию, на 31 процент, что свидетельствует о том, что пневмококк играет важную роль в патогенезе вирус-ассоциированной пневмонии (Madhi, Petersen, Мадхи, Васас и др. 2000).
Попадание бактерий из кишечника с распространением через кровоток в легкие также было предложено для патогенеза грамотрицательных организмов (Fiddian-Green and Baker 1991), но такие бактерии являются необычными этиологическими агентами пневмонии у иммунокомпетентных дети.Однако у новорожденных и младенцев грудного возраста грамотрицательная пневмония не редкость (Quiambao готовится к печати).
Вирусы ответственны за от 40 до 50 процентов инфекций у младенцев и детей, госпитализированных по поводу пневмонии в развивающихся странах (Hortal and others 1990; John and others 1991; Tupasi and others 1990). Вирус кори, RSV, вирусы парагриппа, вирус гриппа типа A и аденовирусы являются наиболее важными причинами вирусной пневмонии. Рентгенологически сложно отличить вирусную пневмонию от бактериальной, отчасти потому, что поражения выглядят одинаково, а отчасти потому, что бактериальная суперинфекция возникает при гриппе, кори и инфекциях RSV (Ghafoor и др., 1990).
В развивающихся странах уровень летальности среди детей с вирусной пневмонией колеблется от 1,0 до 7,3 процента (John and others 1991; Stensballe, Devasundaram, and Simoes 2003), с бактериальной пневмонией от 10 до 14 процентов и со смешанной вирусной и вирусной пневмонией. бактериальные инфекции от 16 до 18 процентов (Ghafoor и др., 1990; Shann, 1986).
Бронхиолит
Бронхиолит возникает преимущественно в первый год жизни и с уменьшающейся частотой во второй и третий годы.Клинические признаки включают учащенное дыхание и втягивание нижней грудной стенки, лихорадку в одной трети случаев и хрипы (Cherian и др., 1990). Воспалительная обструкция мелких дыхательных путей, которая приводит к гиперинфляции легких и коллапсу сегментов легкого. Поскольку признаки и симптомы также характерны для пневмонии, работникам здравоохранения может быть сложно провести различие между бронхиолитом и пневмонией. Две особенности, которые могут помочь, — это определение сезонности RSV в данной местности и умение обнаруживать хрипы.RSV являются основной причиной бронхиолита во всем мире и могут вызывать до 70 или 80 процентов LRI в высокий сезон (Simoes 1999; Stensballe, Devasundaram и Simoes 2003). Недавно обнаруженный метапневмовирус человека также вызывает бронхиолит (Van den Hoogen и др., 2001), который неотличим от болезни RSV. Другие вирусы, вызывающие бронхиолит, включают вирус парагриппа 3-го типа и вирусы гриппа.
Грипп
Несмотря на то, что вирусы гриппа обычно вызывают инфекционные заболевания дыхательных путей у взрослых, они все чаще рассматриваются как важная причина инфекционных заболеваний кишечника у детей и, возможно, вторая по значимости причина госпитализации детей с ОРВ после RSV (Neuzil and others 2002). .Хотя грипп считается нечастым в развивающихся странах, его эпидемиология еще требует тщательного изучения. Потенциальное бремя гриппа как причина смерти детей неизвестно. Вирус гриппа типа A может вызывать сезонные вспышки, а тип B может вызывать спорадические инфекции. В последнее время вирус птичьего гриппа стал причиной инфекции, болезней и смерти небольшого числа людей, включая детей, в нескольких азиатских странах. Его потенциал для возникновения вспышек среди людей или пандемии неизвестен, но он может иметь разрушительные последствия для развивающихся стран (Peiris and others 2004) и может представлять угрозу для здоровья во всем мире.Новые штаммы вирусов типа А почти наверняка возникнут в результате мутации, как это произошло в случае пандемий в Азии и Гонконге в 1950-х и 1960-х годах.
ВИЧ-инфекция и педиатрические LRIs
Во всем мире 3,2 миллиона детей живут с ВИЧ / СПИДом, 85 процентов из них — в странах Африки к югу от Сахары (ЮНЭЙДС, 2002). В южной части Африки инфекционные заболевания, связанные с ВИЧ, составляют от 30 до 40 процентов случаев госпитализации детей и имеют показатель летальности от 15 до 34 процентов, что намного выше, чем 5-10 процентов для детей, не инфицированных ВИЧ (Bobat and others 1999; Мадхи, Петерсен, Мадхи, Хосал и другие, 2000; Натху и другие, 1993; Цви, Петтифиор и Содерлунд, 1999). Pneumocystis jiroveci и цитомегаловирус являются важными условно-патогенными инфекциями более чем у 50 процентов ВИЧ-инфицированных младенцев (Jeena, Coovadia, and Chrystal 1996; Lucas and others 1996). Грамотрицательные бактерии также важны для более чем 70 процентов ВИЧ-инфицированных детей с недостаточным питанием (Ikeogu, Wolf, and Mathe, 1997). Исследования пациентов подтвердили частую ассоциацию этих бактерий, но добавили S. pneumoniae и S. aureus в качестве важных патогенов (Gilks 1993; Goel and others 1999).В первом южноафриканском отчете об общем бремени инвазивной пневмококковой инфекции сообщается о 41,7-кратном увеличении числа ВИЧ-инфицированных детей по сравнению с неинфицированными детьми (Фарли и др., 1994).
Вмешательства
Вмешательства по борьбе с ОРИ можно разделить на четыре основные категории: иммунизация против конкретных патогенов, ранняя диагностика и лечение заболеваний, улучшение питания и более безопасная среда (John 1994). Первые два относятся к сфере компетенции системы здравоохранения, тогда как последние два относятся к сфере общественного здравоохранения и требуют многосекторального участия.
Прививки
Широкое использование вакцин против кори, дифтерии, коклюша, Hib, пневмококка и гриппа может существенно снизить заболеваемость ОРИ у детей в развивающихся странах. Влияние вакцин против кори, дифтерии и коклюша обсуждается в главе 20. Ограниченные данные о гриппе в развивающихся странах не позволяют провести подробный анализ потенциальных преимуществ этой вакцины. Поэтому в этой главе основное внимание уделяется потенциальному воздействию вакцин против Hib и пневмококка на LRI.
Вакцина против Hib
В настоящее время доступны три конъюгированные вакцины против Hib для применения у младенцев и детей младшего возраста. Эффективность вакцины против Hib в предотвращении инвазивных заболеваний (в основном менингита, но также и пневмонии) была хорошо задокументирована в нескольких исследованиях, проведенных в промышленно развитых странах (Black and others 1992; Booy and others 1994; Eskola and others 1990; Fritzell and Plotkin 1992; Heath 1998; Lagos and others 1996; Santosham and others 1991) и в одном исследовании в Гамбии (Mulholland and others 1997).Все исследования показали защитную эффективность более 90% против лабораторно подтвержденных инвазивных заболеваний, независимо от выбора вакцины. Следовательно, все промышленно развитые страны включают вакцину против Hib в свои национальные программы иммунизации, что приводит к фактической ликвидации инвазивной болезни Hib из-за иммунитета у вакцинированных и эффекта стада у тех, кто не вакцинирован. Имеющиеся данные из нескольких развивающихся стран показывают аналогичный эффект стада (Адегбола и др., 1999; Венгер и др., 1999).
Первоначальное обещание и последующее общее мнение заключалось в том, что вакцина против Hib предназначена для защиты от менингита, но в развивающихся странах вакцина, вероятно, будет иметь больший эффект в предотвращении LRI. Эффект легко измерить при инвазивных заболеваниях, включая бактериемическую пневмонию. Вакцина, вероятно, оказывает влияние на небактериемическую пневмонию, но этот эффект трудно определить количественно из-за отсутствия адекватного метода установления бактериальной этиологии. В Бангладеш, Бразилии, Чили и Гамбии вакцина против Hib была связана с уменьшением на 20-30 процентов числа госпитализированных с рентгенологически подтвержденной пневмонией (de Andrade and others 2004; Levine and others 1999; Mulholland and others 1997; WHO 2004a ).Однако результаты большого исследования в Ломбоке, Индонезия, не дали окончательных результатов в отношении влияния вакцины против Hib на пневмонию (Gessner and others 2005).
Пневмококковые вакцины
В настоящее время доступны два вида вакцин против пневмококков: 23-валентная полисахаридная вакцина (23-PSV), которая больше подходит для взрослых, чем для детей, и 7-валентная полисахаридная вакцина, конъюгированная с белком (7- PCV). 9-валентная вакцина (9-PCV) прошла клинические испытания в Гамбии и Южной Африке, а 11-валентная вакцина (11-PCV) проходит испытания на Филиппинах.
Исследования эффективности полисахаридной вакцины в профилактике ОРИ или ушных инфекций у детей в промышленно развитых странах показали противоречивые результаты. В то время как некоторые исследования этой вакцины не показывают значительной эффективности (Douglas and Miles 1984; Sloyer, Ploussard and Howie 1981), исследования из Финляндии показывают в целом защитный эффект против серотипов, содержащихся в 14-PSV (Douglas and Miles 1984; Karma and другие 1980; Макела и другие 1980). Эффективность была более выражена у детей старше двух лет, чем у детей младшего возраста.Единственные исследования, оценивающие действие полисахаридной вакцины на детей в развивающихся странах, — это серия из трех испытаний, проведенных в Папуа-Новой Гвинее (Douglas and Miles 1984; Lehmann and others 1991; Riley and others 1981; Riley, Lehmann, and Alpers 1991). . Анализ объединенных данных этих испытаний показал снижение смертности от LRI на 59 процентов среди детей до пяти лет на момент вакцинации и на 50 процентов среди детей до двух лет. На основании этих и других исследований исследователи пришли к выводу, что вакцина оказывает влияние на тяжелую пневмонию.Более высокая, чем ожидалось, эффективность в этих испытаниях была приписана большему вкладу более иммуногенных серотипов взрослых в пневмонию в Папуа-Новой Гвинее (Douglas and Miles 1984; Riley, Lehmann, and Alpers 1991). Из-за низкой иммуногенности антигенов в 23-PSV против преобладающих детских серотипов внимание теперь направлено на более иммуногенные конъюгированные вакцины (Mulholland 1998; Obaro 1998; Temple 1991).
Эффективность 7-PCV и 9-PCV была оценена на предмет эффективности против инвазивного пневмококкового заболевания в четырех испытаниях, которые продемонстрировали эффективность вакцины от 71.От 0 до 97,4 процента (от 58 до 65 процентов для ВИЧ-положительных детей, среди которых заболеваемость пневмококком в 40 раз выше, чем среди ВИЧ-отрицательных детей) (Black and others 2000; Cutts and others 2005; Klugman and others 2003; O ‘ Брайен и другие 2003).
В США 7-PCV был включен в плановую вакцинацию младенцев и детей в возрасте до двух лет в 2000 году. К 2001 году заболеваемость всеми инвазивными пневмококковыми заболеваниями в этой возрастной группе снизилась на 69 процентов, а заболевания, вызываемые включенными серотипами вакцины и родственных серотипов снизились на 78 процентов (Whitney and others 2003).Подобные сокращения были подтверждены в исследовании в северной Калифорнии (Black and others 2001). Наблюдалось небольшое увеличение частоты инвазивных заболеваний, вызванных серотипами пневмококков, не включенных в вакцину, но оно было недостаточно большим, чтобы компенсировать существенное снижение заболеваемости, вызванное вакциной. Исследования также обнаружили значительное снижение инвазивной пневмококковой инфекции в непривитых старших возрастных группах, особенно среди взрослых в возрасте от 20 до 39 лет и в возрасте 65 лет и старше, что позволяет предположить, что вакцинация маленьких детей оказала значительный эффект в обществе.Такое преимущество может иметь место даже там, где распространенность ВИЧ-инфекции среди взрослых высока, а пневмококковая инфекция может быть рецидивирующей и опасной для жизни.
Воздействие вакцины на пневмококковую пневмонию как таковое трудно определить из-за проблем, связанных с установлением бактериальной этиологии пневмонии. В трех исследованиях оценивали влияние вакцины на рентгенологическую пневмонию (независимо от этиологического агента) и показали снижение на 20,5-37,0% случаев пневмонии, подтвержденной рентгенологически (9.0 процентов для ВИЧ-инфицированных) (Black and others 2000; Cutts and others 2005; Klugman and others 2003).
Несколько полевых испытаний оценили эффективность PCV против ушной инфекции. Несмотря на то, что вакцина привела к значительному сокращению подтвержденного посевом пневмококка отита, чистого снижения ушной инфекции среди вакцинированных детей не наблюдалось, вероятно, из-за увеличения частоты отита, вызванного видами пневмококков, не охваченных вакциной, ЧАС.influenzae и Moraxella catarrhalis (Eskola and others 2001; Kilpi and others 2003). Однако испытание в северной Калифорнии показало, что вакцина обладает защитным действием против частых инфекций уха и снижает потребность в установке тимпаностомической трубки (Fireman and others 2003). Таким образом, вакцина от ушной инфекции может быть полезной в развивающихся странах с высокими показателями хронического отита и кондуктивной тугоухости, и ее следует оценивать с помощью клинических испытаний.
Самым заметным преимуществом вакцины для общественного здравоохранения в развивающихся странах будет очевидное снижение смертности.Хотя первичным результатом исследования в Гамбии изначально была детская смертность, она была изменена на радиологическую пневмонию. Тем не менее, испытание показало снижение смертности на 16 процентов (уровень достоверности 95 процентов, от 3 до 38). Это испытание проводилось в сельской местности на востоке Гамбии, где трудно обеспечить круглосуточную лечебную помощь, включая ведение больных. Это испытание демонстрирует, что иммунизация, проводимая в рамках аутрич-программ, принесет значительную пользу для здоровья и экономики таких групп населения.Еще одно исследование, оценивающее влияние 11-PCV на радиологическую пневмонию, продолжается на Филиппинах; результаты ожидаются во второй половине 2005 года.
Ведение пациентов
Упрощение и систематизация ведения пациентов для ранней диагностики и лечения ОРИ позволили значительно снизить смертность в развивающихся странах, где доступ к педиатрам ограничен. В клинических рекомендациях ВОЗ по ведению случаев ОРИ (ВОЗ, 1991) используются два ключевых клинических признака: частота дыхания, , чтобы отличить детей с пневмонией от детей без, и втягивание нижней грудной стенки, , чтобы определить тяжелую пневмонию, требующую направления и госпитализации.Детям со слышимым стридором в спокойном и спокойном состоянии или такими опасными признаками тяжелого заболевания, как неспособность есть, также требуется направление. Дети без этих признаков классифицируются как страдающие ОРИ, но не пневмонией. Детей, у которых наблюдается только учащенное дыхание, лечат пневмонию амбулаторно. Детей, которые кашляют более 30 дней, направляют для дальнейшего обследования на туберкулез и другие хронические инфекции.
Диагностика пневмонии на основе учащенного дыхания
Первоначальные рекомендации по выявлению пневмонии на основе учащенного дыхания были разработаны в Папуа-Новой Гвинее в 1970-х годах.В исследовании 200 последовательных педиатрических пациентов и 50 последовательных госпитализаций (Shann, Hart, and Thomas 1984) 72 процента детей со слышимым хрипом в легких имели частоту дыхания 50 или более вдохов в минуту, тогда как только 19 процентов детей без потрескивания дышал с такой стремительной скоростью. Поэтому в первоначальных рекомендациях ВОЗ использовался порог в 50 вдохов в минуту, при достижении которого кашель у ребенка считался пневмонией.
Основное беспокойство вызывает относительно низкая чувствительность этого подхода, который может упустить от 25 до 40 процентов случаев пневмонии.Исследование в Веллоре, Индия, показало, что чувствительность можно улучшить, снизив порог до 40 для детей в возрасте от 1 до 4 лет, сохранив порог в 50 вдохов в минуту для младенцев в возрасте от 2 до 11 месяцев (Cherian and others 1988). Последующие исследования показали, что при использовании этих пороговых значений чувствительность улучшилась с 62 до 79 процентов на Филиппинах и с 65 до 77 процентов в Свазиленде, но в то же время специфичность упала с 92 до 77 процентов на Филиппинах и с 92 до 80 процентов. процентов в Свазиленде (Mulholland и др., 1992).На основе этих и других данных (Кэмпбелл, Байасс и др., 1989; Колстад и др., 1997; Перкинс и др., 1997; Редд, 1994; Симоес и др., 1997; Вебер и др., 1997) ВОЗ рекомендует ограничить частоту дыхания на 50 вдохов. в минуту для детей в возрасте от 2 до 11 месяцев и 40 вдохов в минуту для детей в возрасте от 12 месяцев до 5 лет.
Учащенное дыхание, по определению ВОЗ, выявляет около 85 процентов детей с пневмонией, и более 80 процентов детей с потенциально смертельной пневмонией, вероятно, успешно выявляются и лечатся с использованием диагностических критериев ВОЗ.Было показано, что лечение детей с учащенным дыханием антибиотиками снижает смертность (Sazawal and Black 2003). Проблема низкой специфичности критерия учащенного дыхания заключается в том, что от 70 до 80 процентов детей, которые могут не нуждаться в антибиотиках, получат их. Тем не менее, для работников первичной медико-санитарной помощи, для которых важна простота диагностики, учащенное дыхание, несомненно, является наиболее полезным клиническим признаком.
Диагноз пневмонии на основании втягивания грудной стенки
Дети поступают в больницу с тяжелой пневмонией, когда медицинские работники считают, что необходимы кислородные или парентеральные антибиотики (антибиотики, вводимые не перорально), или когда они не уверены в способности матери справиться .Обоснование парентеральных антибиотиков состоит в том, чтобы достичь более высоких уровней антибиотиков и преодолеть опасения по поводу абсорбции пероральных препаратов у больных детей.
В исследовании Папуа-Новой Гвинеи (Shann, Hart, and Thomas 1984) втягивание грудной клетки использовалось в качестве основного показателя тяжести, но исследования, проведенные в разных частях мира, показывают большие различия в темпах втягивания из-за различных определений. Ограничение этого термина втягиванием нижней грудной стенки, определяемым как движение внутрь костных структур грудной стенки с вдохом, предоставило лучший индикатор тяжести пневмонии, который можно научить медработникам.Он более специфичен, чем втяжение межреберных промежутков, которое часто встречается при бронхиолите.
В исследовании, проведенном в Гамбии (Кэмпбелл, Байасс и др., 1989), когорта из 500 детей от рождения до четырех лет посещалась дома еженедельно в течение одного года. За это время в клинику было направлено 222 эпизода LRI (учащенное дыхание, любое втягивание грудной стенки, расширение носа, свистящее дыхание, стридор или признаки опасности). Втяжение грудной клетки имело место в 62 процентах этих случаев, во многих случаях втягивание межреберных мышц.Если бы всех детей с каким-либо втягиванием грудной клетки госпитализировали, их количество превысило бы количество детских стационаров.
Исследования, проведенные на Филиппинах и в Свазиленде (Mulholland и др., 1992), показали, что втягивание нижней грудной стенки было более специфичным, чем втягивание межреберья, для диагностики тяжелой пневмонии, требующей госпитализации. В исследовании Веллора (Cherian and others 1988) втягивание нижней грудной стенки правильно предсказало 79 процентов детей с LRI, которые были госпитализированы педиатром.
Варианты противомикробных препаратов для перорального лечения пневмонии
Выбор противомикробного препарата для лечения основан на хорошо известных данных о том, что большинство бактериальных пневмоний у детей вызывается S. pneumoniae или H. influenzae . Однократная инъекция бензатин-пенициллина, хотя и длится долго, не обеспечивает адекватных уровней пенициллина для уничтожения H. influenzae . У ВОЗ есть технические документы, помогающие оценить соответствующие факторы при выборе противомикробных препаратов первого и второго ряда и сравнения различных противомикробных препаратов в отношении их антибактериальной активности, эффективности лечения и токсичности (ВОЗ, 1990).
Возникновение устойчивости к противомикробным препаратам у S. pneumoniae и H. influenzae вызывает серьезную озабоченность. В некоторых условиях тесты in vitro показывают, что более 50 процентов респираторных изолятов обеих бактерий устойчивы к ко-тримоксазолу, а устойчивость к пенициллину к S. pneumoniae постепенно становится проблемой во всем мире.
При пневмонии, в отличие от менингита, устойчивость возбудителя in vitro не всегда приводит к неэффективности лечения.Сообщения из Испании и Южной Африки предполагают, что пневмонию, вызванную устойчивым к пенициллину S. pneumoniae , можно успешно лечить с помощью достаточно высоких доз пенициллина. Амоксициллин концентрируется в тканях и макрофагах, и уровни препарата напрямую зависят от пероральных дозировок. Поэтому для успешного лечения ушных инфекций, вызванных устойчивым к пенициллину S. pneumoniae , в настоящее время используются более высокие дозы, чем в прошлом, — назначаемые дважды в день. Амоксициллин явно лучше пенициллина при таких инфекциях.Ситуация с ко-тримоксазолом менее ясна (Strauss and others 1998), и перед лицом высоких показателей устойчивости к ко-тримоксазолу амоксициллин может быть лучше для детей с тяжелой пневмонией.
Внутримышечные антибиотики для лечения тяжелой пневмонии
Несмотря на то, что хлорамфеникол активен против S. pneumoniae и H. influenzae, его пероральное всасывание у чрезвычайно больных детей нестабильно. Таким образом, рекомендации ВОЗ рекомендуют вводить хлорамфеникол внутримышечно в половине суточной дозы до срочного направления пациентов с тяжелой пневмонией.Дополнительным объяснением является то, что у крайне больных детей может быть сепсис или менингит, которые трудно исключить, и их необходимо немедленно лечить. Хотя внутривенный хлорамфеникол превосходит внутримышечный хлорамфеникол, процедура может отсрочить срочно необходимое лечение и увеличивает его стоимость.
Исследователи поставили под сомнение адекватность и безопасность внутримышечного хлорамфеникола. Хотя ранние исследования показали, что уровни взрослого в крови после внутримышечного введения были значительно ниже, чем после внутривенного введения, внутримышечный путь введения получил широкое признание после клинических отчетов, которые подтвердили его эффективность.Местные осложнения при внутримышечном введении сукцината левомицетина возникают редко, в отличие от более ранних внутримышечных препаратов. Хотя беспокойство по поводу апластической анемии после приема хлорамфеникола является обычным явлением, это осложнение крайне редко встречается у маленьких детей. Нет никаких доказательств того, что сукцинат хлорамфеникола внутримышечно вызывает побочные эффекты с большей вероятностью, чем другие формы и пути введения хлорамфеникола.
Диагностика гипоксемии на основе критериев ВОЗ
Стратегии ведения случаев ОРИ и комплексного ведения болезней грудного и детского возраста (ИВБДВ) зависят от точного направления больных детей в больницу и правильного стационарного лечения ИРН с применением кислорода или антибиотиков.Гипоксемия (дефицит кислорода в крови) у детей с LRI является хорошим предиктором смертности, коэффициент летальности в 1,2-4,6 раза выше при гипоксемическом LRI, чем при негипоксемическом LRI (Duke, Mgone, and Frank 2001; Onyango and others 1993). ), а кислород снижает смертность. Таким образом, важно как можно раньше выявлять гипоксемию у детей с LRI, чтобы предотвратить смерть. Хотя диагноз острой LRIs очень легко устанавливается путем распознавания тахипноэ, и хотя тяжелая LRI связана с втягиванием грудной стенки, клиническое распознавание гипоксемии более проблематично.Были изучены различные наборы клинических правил для прогнозирования наличия гипоксемии у детей с LRI (Cherian и др., 1988; Onyango и др., 1993; Usen и др., 1999). Хотя некоторые клинические инструменты обладают высокой чувствительностью для выявления гипоксемии, большое количество детей с гипоксемией все же будет пропущено при использовании этих критериев. Пульсоксиметрия — лучший инструмент для быстрого выявления гипоксемии у больных детей. Однако пульсоксиметры дороги и требуют периодических затрат на замену датчиков, по которым они недоступны в большинстве районных или даже специализированных больниц в развивающихся странах.
Руководство по лечению
Текущие рекомендации включают прием ко-тримоксазола два раза в день в течение пяти дней при пневмонии и внутримышечный пенициллин или хлорамфеникол для детей с тяжелой пневмонией. Проблемы повышения устойчивости к ко-тримоксазолу и ненужные направления детей с втягиванием грудной стенки привели к исследованиям, в которых изучаются альтернативы антибиотикам, которые в настоящее время используются при лечении ОРИ. Одно исследование показало, что амоксициллин и котримоксазол одинаково эффективны при нетяжелой пневмонии (Catchup Study Group 2002), хотя амоксициллин стоит в два раза дороже, чем котримоксазол.Что касается продолжительности лечения антибиотиками, исследования в Бангладеш, Индии и Индонезии показывают, что трехдневный пероральный прием котримоксазола или амоксициллина так же эффективен, как пять дней приема любого из препаратов у детей с нетяжелой пневмонией (Agarwal and others 2004; Kartasasmita 2003). ). В многоцентровом исследовании пенициллина, вводимого внутримышечно, и перорального амоксициллина у детей с тяжелой пневмонией, Аддо-Йобо и другие (2004) обнаружили схожие показатели излечения. Поскольку пациенты получали кислород при необходимости от гипоксемии и были переведены на другие антибиотики в случае неудачи, этот режим не подходит для лечения тяжелой пневмонии в амбулаторных условиях.
ВОЗ рекомендует назначать кислород, если он имеется в достаточном количестве, детям с признаками и симптомами тяжелой пневмонии и, если подача ограничена, детям с любым из следующих признаков: неспособность есть и пить, цианоз, частота дыхания выше или равный 70 вдохам в минуту, или серьезное втягивание грудной стенки (ВОЗ, 1993). Кислород следует вводить со скоростью 0,5 литра в минуту для детей младше 2 месяцев и 1 литр в минуту для детей старшего возраста. Поскольку кислород стоит дорого и его не хватает, особенно в отдаленных сельских районах развивающихся стран, ВОЗ рекомендует простые клинические признаки для выявления и лечения гипоксемии.Несмотря на эти рекомендации, исследование 21 учреждения первого уровня и районной больницы в семи развивающихся странах показало, что более 50 процентов госпитализированных детей с LRI неправильно лечились антибиотиками или кислородом (Nolan and others 2001), а в некоторых случаях кислород был недостаточным. в дефиците. Очевидно, что обеспечение кислородом младенцев с гипоксемией спасает жизнь, хотя никаких рандомизированных испытаний, подтверждающих это, не проводилось.
Профилактика и лечение пневмонии у ВИЧ-позитивных детей
Текущие рекомендации группы ВОЗ по ведению пневмонии у ВИЧ-позитивных детей и профилактике Pneumocystis jiroveci следующие (ВОЗ 2003):
Нетяжелая пневмония в возрасте до 5 лет. Пероральный котримоксазол должен оставаться антибиотиком первой линии, но следует использовать пероральный амоксициллин, если он доступен по цене или если ребенок проходил профилактику котримоксазолом.
Тяжелая или очень тяжелая пневмония. Нормальные руководящие принципы ВОЗ по ведению больных следует использовать для детей в возрасте до 2 месяцев. Детям от 2 до 11 месяцев рекомендуются инъекционные антибиотики и лечение пневмонии Pneumocystis jiroveci , а также начинается профилактика пневмонии Pneumocystis jiroveci после выздоровления.Для детей в возрасте от 12 до 59 месяцев лечение состоит из инъекционных антибиотиков и терапии пневмонии Pneumocystis jiroveci . Pneumocystis jiroveci Профилактика пневмонии должна проводиться в течение 15 месяцев детям, рожденным от ВИЧ-инфицированных матерей; однако эта рекомендация редко выполнялась.
Рентабельность вмешательств
Пневмония является причиной примерно пятой части из примерно 10,6 миллиона случаев смерти детей в возрасте до пяти лет в год.Там, где первичная медико-санитарная помощь является слабой, сокращение смертности с помощью мер общественного здравоохранения является приоритетной задачей. Как отмечалось ранее, доступные вмешательства — это первичная профилактика путем вакцинации и вторичная профилактика путем раннего выявления и ведения случаев заболевания.
Рентабельность вакцин против Hib обсуждается в главе 20. Мы не пытались анализировать рентабельность пневмококковых вакцин, потому что глобальные и региональные оценки бремени пневмококковой пневмонии в настоящее время разрабатываются и будут доступны только после позже в 2005 году.Кроме того, текущие цены на вакцины относительно стабильны в развитых странах, но ожидается, что цены для стран с низким и средним уровнем доходов будут значительно ниже, если вакцины закупаются на глобальном тендере.
Мы оцениваем стратегии вмешательства по ведению случаев LRIs у детей в возрасте до пяти лет. Медицинские работники, которые внедряют ведение пациентов, диагностируют LRI на основании учащенного дыхания, втягивания нижней грудной стенки или отдельных признаков опасности у детей с респираторными симптомами.Поскольку этот метод не делает различий между пневмонией и бронхиолитом, а также между бактериальной и вирусной пневмонией, мы группируем эти состояния в общую категорию «клиническая пневмония» (Rudan and others 2004). Этот подход предполагает, что большая часть клинической пневмонии имеет бактериальное происхождение и что медицинские работники могут значительно снизить летальность посредством диагностики частоты дыхания и своевременного приема антибиотиков (Sazawal and Black 2003). Мы рассчитали затраты на лечение по регионам Всемирного банка, используя стандартизованные исходные затраты, предоставленные редакторами томов, и затраты, опубликованные в Международном справочнике по индикаторам цен на лекарства (Management Sciences for Health 2005) и другой литературе ().В анализе рассматриваются четыре категории ведения больных, которые различаются тяжестью инфекции и точкой лечения:
Таблица 25.1
Входные данные для ведения случаев пневмонии в странах с низким и средним уровнем доходов.
нетяжелая пневмония, лечение в больнице
нетяжелая пневмония, лечение в медицинском учреждении
тяжелая пневмония, лечение в больнице
очень тяжелая пневмония, лечение в больнице.
Информация об этих категориях ведения пациентов и их результатах взята из отчета о методологии и предположениях, использованных для оценки затрат на расширение масштабов отдельных медицинских вмешательств, направленных на детей (ВОЗ и Здоровье детей-подростков, готовится к печати). Мы предположили, что для каждого пациента, которого лечит местный медицинский работник, в общей сложности будет три контрольных визита, а не повторные осмотры два раза в день в течение 10 дней, рекомендованные в отчете. Мы также предположили, что все пациенты с тяжелой пневмонией проходят рентгенологическое обследование, а не только 20 процентов, как это предлагается в отчете.Более того, мы приняли пятичасовой рабочий день для общинного медработника, минимальный рабочий день, необходимый для общинных медицинских работников в рамках инициативы «Здоровье и выживание детей» Агентства США по международному развитию (Bhattacharyya and others 2001).
представляет региональные оценки средних затрат на лечение на эпизод для четырех стратегий ведения случая. Поскольку мы считали, что цены на торгуемые товары, такие как лекарства и кислород, постоянны в разных регионах, региональные различия были вызваны различиями в расходах на больницы и медицинских работников.Латинская Америка и Карибский бассейн, Ближний Восток и Северная Африка имели самые высокие затраты на лечение.
Таблица 25.2
Средние затраты на лечение за один эпизод вмешательств по ведению пациентов с острой респираторной инфекцией нижних дыхательных путей (2001 долл. США).
Мы рассчитали региональные коэффициенты экономической эффективности (ССВ) для модельной численности населения в 1 миллион человек в каждом регионе, следуя стандартизированным руководящим принципам для экономического анализа (подробности см. В главе 15). Входные переменные включали стоимость лечения, подробно описанную в и, региональные показатели заболеваемости LRI, адаптированные из материалов Рудана и других (готовится к публикации), региональные показатели смертности и возрастные структуры, предоставленные редакторами томов, а также соотношение городского и сельского населения по регионам (World Банк 2002).Регион Европы и Центральной Азии был исключен из этого анализа из-за отсутствия информации о заболеваемости. В связи с отсутствием информации по регионам, мы предположили, что уровни эффективности вмешательства будут одинаковыми.
Количество лет жизни с поправкой на инвалидность можно предотвратить за счет сокращения продолжительности болезни и снижения смертности с помощью лечения. Мы предположили, что средняя продолжительность болезни составляет 8,5 дней для тех, кто не лечился, и 6,0 дней для тех, кто лечился. Мы использовали снижение летальности на 36,0% за счет лечения (Sazawal and Black 2003) и специфичность диагноза 78.5 процентов для пациентов, которым поставлен диагноз только на основании частоты дыхания. Вес нетрудоспособности одновременно с инфекцией составил 0,28. Мы не рассматривали инвалидность, вызванную хроническими последствиями LRI, потому что неясно, вызывает ли LRI в детстве долгосрочное нарушение функции легких или дети, у которых развивается нарушение функции легких, более склонны к инфекции (von Mutius 2001).
Поскольку один год этих вмешательств дает только одновременные выгоды — поскольку эффективно пролеченные люди не обязательно доживают до ожидаемой продолжительности жизни, учитывая, что они, вероятно, снова заразятся в следующем году, — мы рассчитали рентабельность пятилетнего вмешательства .Этот период времени позволил нам рассмотреть случай, когда целая когорта новорожденных и детей в возрасте от четырех лет избежала смертности от клинической пневмонии в раннем детстве благодаря вмешательству и получила преимущество, дожившее до ожидаемой продолжительности жизни. Наконец, в этом анализе учитывались только долгосрочные предельные затраты, которые варьируются в зависимости от количества пациентов, прошедших лечение, и не учитывались постоянные затраты на запуск программы, которых в настоящее время не существует.
представляет ССВ для конкретных регионов четырех категорий ведения случаев, а также ССВ для предоставления всех четырех категорий населению в 1 миллион человек.Во всех странах с низким и средним уровнем доходов лечение нетяжелой клинической пневмонии было более рентабельным на уровне учреждения, чем на уровне общины, и из всех четырех категорий ведения случая лечение очень тяжелой клинической пневмонии на уровне больниц было более эффективным. наименее рентабельный. Лечение нетяжелой клинической пневмонии на уровне учреждения было более рентабельным, чем лечение общинным работником здравоохранения, из-за более низкой стоимости одного посещения медицинского учреждения, чем многократных посещений медицинского работника.CER предоставления всех уровней лечения для всех стран с низким и средним уровнем доходов оценивается в 398 долларов США на год жизни с поправкой на инвалидность.
Таблица 25.3
ССВ вмешательств по ведению пациентов с пневмонией (2001 долл. США / год жизни с поправкой на инвалидность).
Поскольку мы предположили, что показатели эффективности были постоянными, региональные различия в CER для каждой категории ведения случая были связаны только с вариациями затрат на вмешательство, а относительные рейтинги экономической эффективности для стратегий были одинаковыми для всех регионов.Различия в ССВ для оказания всех категорий медицинской помощи также были обусловлены региональным соотношением городского и сельского населения. Мы предположили, что все пациенты в городских районах обращаются за лечением на уровне учреждения или выше, тогда как 80 процентов нетяжелых пациентов в сельской местности получают лечение на уровне сообщества, а остальные обращаются за лечением на уровне учреждения.
Внедрение стратегий борьбы с ОРИ: уроки опыта
Уроки стратегий профилактики и контроля ОРИ, реализованные в рамках национальных программ, включают стратегии вакцинации и ведения больных, описанные ниже.
Вакцины. Стратегии
Вакцина против Hib была включена в календарь плановой иммунизации младенцев в Северной Америке и Западной Европе в начале 1990-х годов. С созданием Глобального альянса по вакцинам и иммунизации (ГАВИ) и Фонда вакцин был достигнут прогресс в их внедрении в развивающихся странах, хотя серьезные препятствия остаются. К 2002 г. только 84 из 193 стран-членов ВОЗ ввели вакцину против Hib. С тех пор пять стран получили одобрение ГАВИ на поддержку внедрения вакцины против Hib в 2004–2005 годах.
Соединенные Штаты добавили 7-PCV в программу иммунизации младенцев в 2000 году. Некоторые другие промышленно развитые страны планируют включить вакцину в свои национальные программы иммунизации в 2005 году, тогда как другие рекомендуют использовать вакцину только в отдельных группах высокого риска. . В некоторых из этих последних стран определение высокого риска является довольно широким и включает значительную долю всех младенцев. В лицензированном в настоящее время 7-PCV отсутствуют определенные серотипы, важные для развивающихся стран, но 9-PCV и 11-PCV охватывают почти 80 процентов серотипов, вызывающих серьезные заболевания во всем мире.
Несмотря на успех вакцины против Hib в промышленно развитых странах и общепризнанное значение LRI как причины детской смертности, в результате действия ряда взаимосвязанных факторов внедрение вакцины в развивающихся странах было медленным. Устойчивое использование вакцины находится под угрозой в нескольких странах, которые ввели вакцину. Во-первых, масштабы заболеваний и смертей, вызванных Hib, не признаются в этих странах, отчасти из-за недостаточного использования бактериологической диагностики (в результате нехватки оборудования и ресурсов).Во-вторых, поскольку охват, достигнутый с помощью традиционных расширенных программ иммунизации вакцинами, остается низким во многих странах, добавление дополнительных вакцин не было определено в качестве приоритета. В-третьих, развивающиеся страны не предпринимали усилий по установлению полезности вакцины до тех пор, пока вакцина не была лицензирована и не использовалась регулярно в течение нескольких лет в промышленно развитых странах. Следовательно, вакцинация против Hib воспринималась как средство вмешательства для богатых стран. В результате всех этих факторов фактический спрос на вакцину оставался низким, даже когда поддержка предоставлялась через ГАВИ и Фонд вакцин.
В 2004 году правление ГАВИ поручило целевой группе по Hib изучить, как лучше всего поддержать национальные усилия по принятию основанных на фактических данных решений о внедрении вакцины против Hib. На основе рекомендаций целевой группы правление ГАВИ одобрило создание Инициативы против Hib для поддержки тех стран, которые желают либо продолжить вакцинацию против Hib, либо изучить вопрос о том, должно ли внедрение вакцины против Hib быть приоритетом для их систем здравоохранения. Консорциум, состоящий из Школы общественного здравоохранения Блумберга Джонса Хопкинса, Лондонской школы гигиены и тропической медицины, Центров по контролю и профилактике заболеваний и ВОЗ, был выбран для руководства этими усилиями.
Стратегии ведения случаев
Метаанализ исследований Сазавала и Блэка (Sazawal and Black, 2003) на уровне сообществ, посвященных стратегии ведения случаев ОРИ, включает 10 исследований, в которых оценивалось ее влияние на смертность, 7 с одновременной контрольной группой. Метаанализ показал снижение смертности от всех причин на 27 процентов среди новорожденных, на 20 процентов среди младенцев и на 24 процента среди детей в возрасте от одного до четырех лет. Смертность от LRI снизилась на 42, 36 и 36 процентов соответственно. Эти данные ясно показывают, что относительно упрощенное, но стандартизованное ведение случаев ОРИ может иметь значительное влияние на смертность не только от пневмонии, но и от других причин у детей от рождения до четырех лет.В настоящее время стратегия ведения пациентов с ОРИ включена в стратегию ИВБДВ, которая в настоящее время применяется более чем в 80 странах (см. Главу 63).
Несмотря на то, что каждый год из-за пневмонии гибнет огромное количество людей, обещания, заложенные в упрощенном ведении больных, не были успешно реализованы во всем мире. Одна из основных причин — недостаточное использование медицинских учреждений в странах или сообществах, в которых многие дети умирают от ОРИ. В Бангладеш, например, 92 процента больных детей не попадают в соответствующие медицинские учреждения (ВОЗ, 2002 г.).В Боливии 62 процента умерших детей не были доставлены к врачу в случае болезни (Aguilar and others 1998). В Гвинее 61 процент умерших больных детей не были доставлены к врачу (Schumacher and others 2002). Исследование Шелленберга и других (2003), проведенное в Танзании, показывает, что дети из более бедных семей реже получают антибиотики от пневмонии, чем дети из более обеспеченных семей, и что только 41 процент больных детей доставляют в медицинские учреждения.Таким образом, исследования неизменно подтверждают, что больные дети, особенно из бедных семей, не посещают медицинские учреждения.
Ряд стран разработали крупномасштабные и устойчивые программы лечения на уровне сообществ:
- В Гамбии действует национальная программа лечения пневмонии на уровне общин (ВОЗ 2004b).
- В районе Сиая в Кении неправительственная организация эффективно предоставляет медицинскими работниками лечение пневмонии и других детских болезней (ВОЗ, 2004b).
- В Гондурасе управление ОРИ было включено в Национальную интегрированную программу общинного ухода за детьми, в соответствии с которой добровольцы из местных сообществ проводят мониторинг роста, проводят санитарное просвещение и лечат пневмонию и диарею в более чем 1800 сообществах (ВОЗ 2004b).
В Бангладеш Комитет по развитию сельских районов Бангладеш и правительство внедрили программу борьбы с ОРИ, охватывающую 10 подокругов, с привлечением добровольцев из местных медицинских работников. Каждый работник отвечает за лечение детской пневмонии примерно в 100–120 домашних хозяйствах после трехдневной программы обучения.
- В Непале в 1986–89 гг. Общинная программа лечения ОРИ и диарейных заболеваний была протестирована в двух округах и показала существенное снижение смертности от LRI (Pandey and others 1989, 1991). В результате программа была интегрирована в службы здравоохранения Непала и реализуется в 17 из 75 округов страны женщинами-добровольцами, обученными выявлять и лечить пневмонию.
- В Пакистане в программе Lady Health Worker Program работает около 70 000 женщин, которые работают в общинах, обеспечивая образование и ведение детской пневмонии более чем 30 миллионам человек (ВОЗ 2004b).
Программа исследований и разработок
Программа исследований и разработок, изложенная ниже, суммирует приоритеты, установленные консультативными группами Инициативы по исследованиям вакцин (стратегии вмешательства в отношении вакцин) и Отдела ВОЗ по охране здоровья детей и подростков (случай — стратегии управления).
Стратегии вакцинации
Целевая группа ГАВИ по иммунизации против Hib дала ряд рекомендаций, которые различаются в зависимости от страны.Страны, внедрившие вакцину против Hib, должны сосредоточиться на документировании ее эффекта и должны использовать данные для информирования национальных органов власти, партнеров по развитию и других учреждений, занимающихся общественным здравоохранением, для обеспечения постоянной поддержки таких программ вакцинации. Страны, имеющие право на поддержку ГАВИ, которые еще не внедрили вакцины против Hib, часто сталкиваются с ограничениями из-за отсутствия местных данных и недостаточной осведомленности о региональных данных. Они могут решать эти вопросы на субрегиональных встречах, на которых страновые эксперты могут объединять данные и анализировать информацию из других стран.Кроме того, большинству стран необходимо проводить экономический анализ, основанный на стандартизированном инструменте. Наконец, всем странам, которые сталкиваются с высоким бременем Hib-инфекции, необходимо создать лабораторное оборудование, чтобы они могли определять заболеваемость Hib-менингитом в выбранных местах. Страны, в которых бремя болезни остается неясным, могут иметь ограниченные возможности для документирования случаев заболевания Hib с использованием протоколов, основанных на эпиднадзоре за инвазивным менингитом. Им необходимо будет изучить возможности использования альтернативных методов измерения бремени болезней, включая использование исследований вакцины.
Основываясь на опыте внедрения вакцин против Hib и гепатита B, ГАВИ проявил инициативу и в 2003 году на базе Школы общественного здравоохранения Джона Хопкинса в Балтиморе учредил инициативу по реализации программы ускоренной разработки и внедрения пневмококковых вакцин ( PneumoADIP; см. Http://www.preventpneumonia.org). Целью программы является установление и информирование о ценности пневмококковых вакцин и поддержка их доставки. Установление ценности вакцины требует разработки местных данных о бремени болезни и потенциальном воздействии вакцины на здоровье населения.Эти усилия могут быть достигнуты за счет усиленного эпиднадзора за болезнями и соответствующих клинических испытаний в выбранном количестве ведущих стран. После создания доказательная база будет передана лицам, принимающим решения, и ключевым лидерам общественного мнения, чтобы гарантировать принятие решений на основе данных. После того, как будет установлена рентабельность плановой вакцинации, необходимо будет создать системы доставки, и странам потребуется финансовая поддержка, чтобы вакцины могли быть включены в их программы иммунизации.Эти мероприятия инициируются до выпуска вакцин, предназначенных для использования в развивающихся странах, чтобы информировать о планировании потенциала, доступности продуктов и ценообразовании.
Стратегии ведения случаев
В 2003 г. Отдел здоровья детей и подростков ВОЗ созвал совещание для обзора данных и доказательств недавних исследований лечения ОРИ и предложения следующих изменений в руководящие принципы ведения случаев и приоритеты будущих исследований:
- Нетяжелая пневмония:
Повышение специфичности клинических диагностических критериев.
Пересмотреть текущие рекомендуемые ВОЗ критерии для выявления и лечения неудач лечения с учетом высоких показателей неудач терапии.
Проведите повторный анализ данных краткосрочных курсов терапии, чтобы лучше определить факторы, определяющие неэффективность лечения.
Провести плацебо-контролируемые испытания среди детей с хрипом и пневмонией в выбранных условиях с высокой распространенностью хрипов, чтобы определить, нуждаются ли такие дети в антибиотиках.
- Тяжелая пневмония. В рандомизированном клиническом исследовании в контролируемой среде Аддо-Йобо и другие (2004) показали, что пероральный амоксициллин так же эффективен, как парентеральный пенициллин или ампициллин; тем не менее, прежде чем его можно будет рекомендовать в целом, необходимо предпринять следующие действия:
Проанализировать данные об исключениях из исследования.
Определите предикторы, которые могут помочь отличить детей, нуждающихся в госпитализации и у которых впоследствии ухудшается состояние.
Переоценить текущие критерии неэффективности лечения, рекомендованные ВОЗ для тяжелой пневмонии, с учетом общих высоких показателей неэффективности терапии.
Провести описательные исследования в условиях общественного здравоохранения в нескольких центрах по всему миру, чтобы оценить клинические результаты перорального приема амоксициллина у детей в возрасте от 2 до 59 месяцев, у которых наблюдается втягивание нижней грудной стенки.
Задокументировать эффективность руководящих принципов ВОЗ по лечению детей с пневмонией и ВИЧ-инфекцией.
- LRI смертей:
Чтобы помочь разработать более эффективные меры по снижению смертности от LRI, подробно изучите эпидемиологию смертей от LRI в различных регионах, используя рутинные и современные лабораторные методы.
- Кислородная терапия:
Проведите исследования, чтобы показать эффективность кислорода для лечения тяжелых респираторных инфекций.
Соберите базовую информацию о наличии и доставке кислорода и его использовании в больницах в странах с низким уровнем дохода.
Изучите возможности пульсоксиметрии для оптимизации кислородной терапии в различных клинических условиях.
Провести исследования для улучшения специфичности клинических признаков при наложении признаков и симптомов малярии и пневмонии.
Изучите быстрые диагностические тесты на малярию, чтобы оценить их эффективность в различении малярии и пневмонии.
Изучить влияние широкого применения котримоксазола на устойчивость к сульфадоксин-пириметамину к Plasmodium falciparum .
Этиология: Данные об этиологии пневмонии у детей несколько устарели, и необходимы новые этиологические исследования, в которых используются современные технологии для идентификации патогенов.
Выводы: обещания и ловушки
Фактические данные ясно показывают, что подход ВОЗ к ведению больных и более широкое использование имеющихся вакцин снизят смертность от ОРИ среди детей младшего возраста от половины до двух третей. Само по себе систематическое применение упрощенного ведения больных, стоимость которого достаточно низка, чтобы быть доступным практически для любой развивающейся страны, снизит смертность от ОРИ как минимум на треть.Срочно нужно воплотить эту информацию в жизнь.
Стратегия ведения случая должна применяться и проспективно оцениваться, чтобы возникающие проблемы устойчивости к противомикробным препаратам, снижение эффективности текущего лечения рекомендованными противомикробными препаратами или появление неожиданных патогенов могли быть обнаружены на ранней стадии и чтобы можно было быстро принять меры по исправлению положения. Если действия медицинских работников на уровне сообществ будут дополнены внедрением стратегии ИВБДВ на всех уровнях первичной медико-санитарной помощи, то применение и оценка этой стратегии будет проще.Такая синергия также может помочь в сборе информации, которая поможет в дальнейшей точной настройке клинических признаков, чтобы даже сельские медицинские работники могли лучше отличить бронхиолит и хрипы от бактериальной пневмонии. Критике того, что меры по ведению пациентов могут привести к чрезмерному использованию противомикробных препаратов, следует противодействовать путем документального подтверждения их чрезмерного и неправильного использования врачами и другими медицинскими работниками. Хотя наблюдается возрождение интереса к проведению вмешательств на уровне сообществ, наш анализ показывает, что это может оказаться нерентабельным.В самом деле, ведение пациентов с ОРИ в учреждении первого уровня все еще может быть наиболее рентабельным в сочетании с более эффективными поведенческими вмешательствами при обращении за медицинской помощью.
Международное медицинское сообщество только начинает осознавать потенциальные преимущества вакцин против Hib и пневмококка. В настоящее время они дороги по сравнению с вакцинами Расширенной программы иммунизации, но цена вакцины Hib может упасть с выходом на рынок большего числа производителей в ближайшие несколько лет. Тем не менее, убедительные доказательства экономической эффективности вакцин необходимы для облегчения принятия национальных решений по внедрению вакцины и ее устойчивому использованию.В странах с низким уровнем дохода одних только положительных соотношений затрат и выгод и экономической эффективности оказывается недостаточно для включения этих вакцин в национальные программы иммунизации.
Ссылки
- Аддо-Йобо Э., Чисака Н., Хассан М., Хибберд П., Лозано Дж. М., Джина П. и др. Пероральный амоксициллин по сравнению с инъекционным пенициллином при тяжелой пневмонии у детей в возрасте от 3 до 59 месяцев: рандомизированное многоцентровое исследование эквивалентности. Ланцет. 2004. 364 (9440): 1141–48. [PubMed: 15451221]
- Адегбола Р.A., Falade A. G., Sam B. E., Aidoo M., Baldeh I., Hazlett D. et al. Этиология пневмонии у недоедающих и хорошо питающихся детей Гамбии. Журнал детских инфекционных болезней. 1994. 13 (11): 975–82. [PubMed: 7845751]
- Адегбола Р. А., Усен С. О., Вебер М., Ллойд-Эванс Н., Джоб К., Малхолланд К. и др. Haemophilus influenzae Менингит типа B в Гамбии после введения конъюгированной вакцины. Ланцет. 1999; 354 (9184): 1091–92. [PubMed: 10509502]
Агилар, А.М., Р. Альварадо, Д. Кордеро, П. Келли, А. Замора и Р. Сальгадо. 1998 г. Обследование смертности в Боливии: окончательный отчет — исследование и определение причин смерти детей в возрасте до пяти лет . Вена, Вирджиния: Базовая поддержка проекта институционализации выживания детей.
- Берман С. Средний отит у детей. Медицинский журнал Новой Англии. 1995a; 332 (23): 1560–65. [PubMed: 7739711]
- ———. 1995b Отит медиа в развивающихся странах, педиатрия 961, часть 1126–31. [PubMed: 7596700]
Бхаттачарья, К., П. Винч, К. ЛеБан и М. Тьен. 2001. «Стимулы и сдерживающие факторы для работников здравоохранения в сообществе: как они влияют на мотивацию, удержание и устойчивость». Basic Support for Institutionalizing Child Survival Project Агентства США по международному развитию, Арлингтон, Вирджиния.
- Блэк Р. Э., Моррис С. С., Брайс Дж. Где и почему 10 миллионов детей умирают каждый год? Ланцет. 2003. 361 (9376): 2226–34. [PubMed: 12842379]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Льюис Э., Рэй П., Хансен Дж. Р. Группа Центра изучения вакцин Kaiser Permanente Северной Калифорнии. Эффективность, безопасность и иммуногенность гептавалентной пневмококковой конъюгированной вакцины у детей. Журнал детских инфекционных болезней. 2000. 19 (3): 187–95. [PubMed: 10749457]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Хиатт Р. Безопасность, иммуногенность и эффективность олигосахаридного конъюгата у младенцев Haemophilus influenzae Вакцина типа B для населения США: возможные последствия для оптимального использования.Журнал инфекционных болезней. 1992; 165 (Приложение 43): S139–43. [PubMed: 1588149]
- Блэк С. Б., Шайнфилд Х. Р., Хансен Дж., Элвин Л., Лауфер Д., Малиноски Ф. Постлицензионная оценка эффективности семивалентной пневмококковой конъюгированной вакцины. Журнал детских инфекционных болезней. 2001. 20 (12): 1105–7. [PubMed: 11740313]
- Бобат Р., Кувадия Х. М., Мудли Д., Коутсудис А. Смертность в когорте детей, рожденных ВИЧ-инфицированными женщинами из Дурбана, Южная Африка. Южноафриканский медицинский журнал.1999. 89 (6): 646–48. [PubMed: 10443216]
- Booy R., Hodgson S., Carpenter L., Mayon-White R. T., Slack M. P., Macfarlane J. A. et al. Эффективность Haemophilus influenzae PRP-T конъюгированной вакцины типа B. Ланцет. 1994. 344 (8919): 362–66. [PubMed: 7 6]
- Брайс Дж., Боски-Пинто К., Сибуя К., Блэк Р. Э. Справочная группа ВОЗ по эпидемиологии здоровья детей. . Оценки ВОЗ причин смерти у детей. Ланцет. 2005; 365: 1147–52. [PubMed: 15794969]
- Кэмпбелл Х., Армстронг Дж. Р. М., Байасс П. Загрязнение воздуха в помещениях в развивающихся странах и острая респираторная инфекция у детей. Ланцет. 1989; 1 (8645): 1012. [PubMed: 2565480]
- Кэмпбелл Х., Байасс П., Ламонт А. С., Форги И. М., О’Нил К. П., Ллойд-Эанс Н., Гринвуд Б. М. Оценка клинических критериев для выявления тяжелых острых инфекций нижних дыхательных путей у детей. Ланцет. 1989; 1 (8633): 297–99. [PubMed: 2563457]
- Группа изучения догоняющих событий. Клиническая эффективность ко-тримоксазола по сравнению с амоксициллином дважды в день для лечения пневмонии: рандомизированное контролируемое клиническое испытание в Пакистане.Архив болезней детства. 2002; 86: 113–18. [Бесплатная статья PMC: PMC1761064] [PubMed: 11827905]
- Cherian T., John T. J., Simoes E. A., Steinhoff M. C., John M. Оценка простых клинических признаков для диагностики острой инфекции нижних дыхательных путей. Ланцет. 1988. 2: 125–28. [PubMed: 2899187]
- Cherian T., Simoes E. A., Steinhoff M. C., Chitra K., John M., Raghupathy P. et al. Бронхиолит в тропической южной Индии. Американский журнал болезней детей. 1990; 144 (9): 1026–30.[PubMed: 2396617]
- Каттс Ф. Т., Заман С. М. А., Энвере Г., Джаффар С., Левин О. С., Ококо Дж. Б. и др. Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное, двойное слепое, плацебо-контролируемое испытание. Ланцет. 2005; 365 (9465): 1139–46. [PubMed: 15794968]
- де Андраде А. Л., де Андраде Дж. Г., Мартелли К. М., Сильва С. А., де Оливейра Р. М., Коста М. С. и др. Эффективность конъюгированной вакцины Haemophilus influenzae B при детской пневмонии: исследование случай-контроль в Бразилии.Международный журнал эпидемиологии. 2004. 33 (1): 173–81. [PubMed: 15075166]
- Денни Ф. У. мл. Клиническое влияние респираторных вирусных инфекций человека. Американский журнал респираторной медицины и реанимации. 1995; 152 (4, часть 2): S4–12. [PubMed: 7551411]
- Dobson M. Концентраторы кислорода обеспечивают экономию средств для развивающихся стран: исследование, основанное на Новой Гвинее. Анестезия. 1991; 146: 217–19. [PubMed: 2014901]
- Дуглас Р. М., Майлз Х. Б. Вакцинация против Streptococcus pneumoniae в детстве: отсутствие очевидной пользы для маленьких австралийских детей.Журнал инфекционных болезней. 1984. 149 (6): 861–69. [PubMed: 6376653]
- Герцог Т., Мгоне Дж., Фрэнк Д. Гипоксемия у детей с тяжелой пневмонией в Папуа-Новой Гвинее. Международный журнал туберкулеза и болезней легких. 2001; 5: 511–19. [PubMed: 11409576]
- Эскола Дж., Кайхти Х., Такала А. К., Пелтола Х., Роннберг П. Р., Кела Э. и др. Рандомизированное проспективное полевое испытание конъюгированной вакцины для защиты младенцев и детей младшего возраста от инвазивной болезни Haemophilus influenzae типа B.Медицинский журнал Новой Англии. 1990. 323 (20): 1381–87. [PubMed: 2233904]
- Eskola J., Kilpi T., Palmu A., Jokinen J., Haapakoski J., Herva E. et al. Эффективность пневмококковой конъюгированной вакцины против острого среднего отита. Медицинский журнал Новой Англии. 2001. 344 (6): 403–409. [PubMed: 11172176]
- Фарли Дж., Кинг Дж. К., Наир П., Хайнс С. Э., Трессиер Р. Л., Винк П. Э. Инвазивное пневмококковое заболевание среди инфицированных и неинфицированных детей матерей с инфекцией, вызванной вирусом иммунодефицита человека.Журнал педиатрии. 1994; 124: 853–58. [PubMed: 8201466]
- Фиддиан-Грин Р. Г., Бейкер С. Нозокомиальная пневмония у критически больных: продукт аспирации или перемещения? Реанимационная медицина. 1991; 19: 763–69. [PubMed: 2055052]
- Файерман Б., Блэк С. Б., Шайнфилд Х. Р., Ли Дж., Льюис Э., Рэй П. Воздействие пневмококковой конъюгированной вакцины на средний отит. Журнал детских инфекционных болезней. 2003. 22 (1): 10–16. [PubMed: 12544402]
- Фритцелл Б., Плоткин С. Эффективность и безопасность вакцины, конъюгированной с капсульным полисахаридом столбняка и белком столбняка, Haemophilus influenzae.Журнал педиатрии. 1992. 121 (3): 355–62. [PubMed: 1517908]
- Гесснер Б. Д., Сутанто А., Линехан М., Джелантик И. Г., Флетчер Т., Герудуг И. К. и др. Заболеваемость гемофильной пневмонией и менингитом, предотвращаемым вакцинацией, Haemophilus Influenzae у индонезийских детей: рандомизированное исследование вакцины Hamlet. Ланцет. 2005; 365 (9453): 43–52. [PubMed: 15643700]
- Гафур А., Номани Н. К., Исхак З., Заиди С. З., Анвар Ф., Берни М. И. и др. Диагностика острых инфекций нижних дыхательных путей у детей в Равалпинди и Исламабаде, Пакистан.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S907–14. [PubMed: 2270413]
- Гилкс К. Ф. Пневмококковая болезнь и ВИЧ-инфекция. Анналы внутренней медицины. 1993; 118: 393–94. [PubMed: 8430986]
- Гоэль А., Бэмфорд Л., Хансло Д., Хасси Г. Первичная стафилококковая пневмония у детей раннего возраста: обзор 100 случаев. Журнал тропической педиатрии. 1999. 45 (4): 233–36. [PubMed: 10467836]
- Hament J. M., Aerts P. C., Fleer A., Van Dijk H., Harmsen T., Kimpen J. L., Wolfs T.F. Повышенная адгезия Streptococcus pneumoniae к эпителиальным клеткам человека, инфицированным респираторно-синцитиальным вирусом. Педиатрические исследования. 2004; 55 (6): 972–78. [PubMed: 15103015]
- Heath P. T. Haemophilus influenzae Конъюгированные вакцины типа B: обзор данных об эффективности. Журнал детских инфекционных болезней. 1998. 17 (9 доп.): S117–22. [PubMed: 9781743]
- Hortal M., Mogdasy C., Russi J. C., Deleon C., Suarez A. Микробные агенты, ассоциированные с пневмонией у детей из Уругвая.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S915–22. [PubMed: 2270414]
- Икеогу М. О., Вольф Б., Мате С. Легочные проявления у ВИЧ-серопозитивных и недоедающих детей в Зимбабве. Архив болезней детства. 1997. 76: 124–28. [Бесплатная статья PMC: PMC1717076] [PubMed:
- 01]
- Джина П. М., Кувадия Х. М., Кристал В. Pneumocystis carinii и cytomegalo Вирусные инфекции у тяжелобольных ВИЧ-инфицированных африканских младенцев. Анналы тропической педиатрии.1996; 16: 361–68. [PubMed: 8985536]
- Цзян З., Нагата Н., Молина Э., Бакалетз Л. О., Хокинс Х., Патель Дж. А. Усиленное прикрепление нетипируемого Haemophilus influenzae , инфицированного респираторно-синцитиальным вирусом, к респираторным эпителиальным клеткам, инфицированным синцитиальным вирусом. Инфекция и иммунитет. 1999; 67: 187–92. [Бесплатная статья PMC: PMC96295] [PubMed: 9864214]
Джон Т. Дж. 1994. «Кто определяет национальную политику здравоохранения?» In Вакцинация и здоровье в мире: четвертый ежегодный форум общественного здравоохранения Лондонской школы гигиены и тропической медицины , изд.Каттс Ф. Т., Смит П. Г., 205–11. Чичестер, Великобритания: Джон Вили.
- Джон Т. Дж., Чериан Т., Стейнхофф М. К., Симоэс Э. А., Джон М. Этиология острых респираторных инфекций у детей в тропиках на юге Индии. Обзоры инфекционных болезней. 1991; 13 (Приложение 6): S463–69. [PubMed: 1862277]
- Камат К. Р., Фельдман Р. А., Рао П. С., Уэбб Дж. К. Инфекция и болезнь в группе южноиндийских семей. Американский журнал эпидемиологии. 1969; 89: 375–83. [PubMed: 5778926]
- Карма П., Луотонен Дж., Тимонен М., Понтинен С., Пукандер Дж., Херва Э. и др. Эффективность пневмококковой вакцины против рецидивирующего среднего отита: предварительные результаты полевых испытаний в Финляндии. Annals of Otology, Rhinology, and Laryngology Suppl. 1980. 89 (3, часть 2): 357–62. [PubMed: 6778346]
Картасасмита, С. 2003. «Пероральный котримоксазол три или пять дней при нетяжелой пневмонии». Документ, представленный на Консультативном совещании Всемирной организации здравоохранения по обзору текущих исследований и лечению острых респираторных инфекций, Женева, 29 сентября — 1 октября.
- Килпи Т., Ахман Х., Йокинен Дж., Ланкинен К. С., Палму А., Саволайнен Х. и др. Защитная эффективность второй пневмококковой конъюгированной вакцины против пневмококкового острого среднего отита у младенцев и детей: рандомизированное контролируемое испытание семивалентной конъюгированной вакцины комплекса пневмококкового полисахарида и менингококкового белка внешней мембраны с 7-валентными соединениями у 1666 детей. Клинические инфекционные болезни. 2003. 37 (9): 1155–64. [PubMed: 14557958]
- Клугман К. П., Мадхи С. А., Хюбнер Р.E., Kohberger R., Mbelle N., Pierce N. et al. Испытание пневмококковой конъюгированной вакцины 9-Valent у детей с ВИЧ-инфекцией и без нее. Медицинский журнал Новой Англии. 2003. 349 (14): 1341–48. [PubMed: 14523142]
- Колстад П. Р., Бернем Г., Калтер Х. Д., Кения-Мугиша Н., Блэк Р. Э. Комплексное ведение детских болезней в Западной Уганде. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 77–85. [Бесплатная статья PMC: PMC2486998] [PubMed: 9529720]
- Lagos R., Хорвиц И., Торо Дж., Сан Мартин О., Абрего П., Бустаманте С. и др. Крупномасштабная, постлицензионная, селективная вакцинация чилийских младенцев конъюгированной вакциной PRP-T: практичность и эффективность в предотвращении инвазивных инфекций Haemophilus influenzae типа B. Журнал детских инфекционных болезней. 1996; 15: 216–22. [PubMed: 8852909]
- Леманн Д., Маршалл Т. Ф., Райли И. Д., Альперс М. П. Влияние пневмококковой вакцины на заболеваемость острыми инфекциями нижних дыхательных путей у детей Папуа-Новой Гвинеи.Анналы тропической педиатрии. 1991. 11 (3): 247–57. [PubMed: 1719924]
- Левин О. С., Лагос Р., Муньос А., Вильяроэль Дж., Альварес А. М., Абрего П. и др. Определение бремени пневмонии у детей, которую можно предотвратить с помощью вакцинации против Haemophilus influenzae Тип B. Журнал детских инфекционных болезней. 1999. 18 (12): 1060–64. [PubMed: 10608624]
- Лукас С. Б., Пикок С. С., Хунноу А., Браттегаард К., Коффи К., Хонд М. и др. Заболевание детей, инфицированных ВИЧ в Абиджане, Кот-д’Ивуар.Британский медицинский журнал. 1996; 312: 335–38. [Бесплатная статья PMC: PMC2350283] [PubMed: 8611829]
- Мадхи С.А., Петерсен К., Мадхи А., Хосал М., Клугман К.П. Повышенное бремя болезней и устойчивость бактерий к антибиотикам, вызывающая тяжелые инфекции нижних дыхательных путей, приобретенные в сообществе Дети, инфицированные вирусом иммунодефицита человека 1. Клинические инфекционные болезни. 2000. 31: 170–76. [PubMed: 10
- 7]
- Мадхи С. А., Петерсен К., Мадхи А., Васас А., Клугман К. П.Влияние вируса иммунодефицита человека типа 1 на спектр заболеваний Streptococcus pneumoniae у детей Южной Африки. Журнал детских инфекционных болезней. 2000. 19 (12): 1141–47. [PubMed: 11144373]
- Макела П. Х., Сибаков М., Херва Э., Хенрихсен Дж., Луотонен Дж., Тимонен М. и др. Пневмококковая вакцина и средний отит. Ланцет. 1980; 2 (8194): 547–51. [PubMed: 6106735]
Управленческие науки для здравоохранения. 2005. Международный справочник по индикаторам цен на лекарства .Кембридж, Массачусетс: Управленческие науки для здоровья.
- МакКуллерс Дж. А., Бартмесс К. С. Роль нейраминидазы в летальном синергизме между вирусом гриппа и Streptococcus pneumoniae . Журнал инфекционных болезней. 2003. 187: 1000–9. [PubMed: 12660947]
- Монто А. С., Ульман Б. М. Острое респираторное заболевание в американском сообществе: исследование Текумсе. Журнал Американской медицинской ассоциации. 1974. 227 (2): 164–69. [PubMed: 4357298]
- Малхолланд К., Усен С., Адегбола Р., Вебер Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998. 352 (9127): 575–76. [PubMed: 9716087]
- Малхолланд Э. К., Симоэс Э. А., Касталес М. О., МакГрат Э. Дж., Маналак Э. М., Гоув С. Стандартизированная диагностика пневмонии в развивающихся странах. Журнал детских инфекционных болезней. 1992; 11: 77–81. [PubMed: 1741202]
- Малхолланд К., Хилтон С., Адегбола Р., Усен С., Опарауго А., Омосиго С. и др. Рандомизированное исследование Haemophilus influenzae вакцины конъюгированной против столбняка с белком типа B для профилактики пневмонии и менингита у младенцев в Гамбии.Ланцет. 1997. 349 (9060): 1191–97. [PubMed:
- 39]
- Натху К. Дж., Нкрума Ф. К., Ндлову Д., Нхембе Д., Пири Дж., Ково Х. Острая инфекция нижних дыхательных путей у госпитализированных детей в Зимбабве. Анналы тропической педиатрии. 1993; 13: 253–61. [PubMed: 7505550]
- Нойзил К. М., Чжу Ю., Гриффин М. Р., Эдвардс К. М., Томпсон Дж. М., Толлефсон С. Дж., Райт П. Ф. Бремя межпандемического гриппа у детей младше 5 лет: 25-летнее перспективное исследование. Журнал инфекционных болезней.2002; 185: 147–52. [PubMed: 11807687]
- Nolan T., Angos P., Cunha A. J., Muhe L., Qazi S., Simoes E. A. et al. Качество стационарной помощи тяжелобольным детям в менее развитых странах. Ланцет. 2001. 357 (9250): 106–10. [PubMed: 11197397]
- Обаро С., Лич А., Макадам К. В. Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998; 352 (9127): 575. [PubMed: 9716086]
- О’Брайен К. Л., Моултон Л. Х., Рид Р., Уэзерхольц Р., Оски Дж., Браун Л. и др. Эффективность и безопасность семивалентной конъюгированной пневмококковой вакцины у детей американских индейцев: групповое рандомизированное исследование.Ланцет. 2003. 362 (9381): 355–61. [PubMed: 12 8]
- Оньянго Ф. Э., Стейнхофф М. К., Вафула Э. М., Вариуа С., Мусиа Дж., Китони Дж. Гипоксемия у маленьких кенийских детей с острой инфекцией нижних дыхательных путей. Британский медицинский журнал. 1993. 306 (6878): 612–15. [Бесплатная статья PMC: PMC1676956] [PubMed: 8369033]
- Пандей М. Р., Даулер Н. М., Старбак Э. С., Хьюстон Р. М., Макферсон К. Снижение общей смертности детей в возрасте до пяти лет в Западном Непале с помощью противомикробного лечения пневмонии на уровне местных сообществ.Ланцет. 1991. 338 (8773): 993–97. [PubMed: 1681351]
- Пандей М. Р., Шарма П. Р., Губхаджу Б. Б., Шакья Г. М., Неупане Р. П., Гаутам А. и др. Воздействие пилотной программы борьбы с острыми респираторными инфекциями (ОРИ) в сельском сообществе Горного региона Непала. Анналы тропической педиатрии. 1989. 9 (4): 212–20. [PubMed: 2482002]
- Педерсон Дж., Найроп М. Анестезиологическое оборудование для развивающихся стран. Британский журнал анестезии. 1991; 66: 264–70. [PubMed: 1817634]
- Пейрис Дж.S., Yu W. C., Leung C. W., Cheung C. Y., Ng W. F., Nicholls J. M. et al. Повторное появление заболевания подтипа H5N1 гриппа человека со смертельным исходом. Ланцет. 2004; 363 (9409): 617–19. [Бесплатная статья PMC: PMC7112424] [PubMed: 14987888]
- Перкинс Б. А., Цукер Дж. Р., Отинео Дж., Джафари Х. С., Пакстон Л., Редд С. С. и др. Оценка алгоритма интегрированного ведения детских болезней в районе Кении с высоким уровнем передачи малярии. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 33–42.[Бесплатная статья PMC: PMC2487004] [PubMed: 9529716]
Киамбао, Б. П., Э. А. Симоес, Э. Абучехо-Ладесма, Л. С. Гозум, С. П. Луписан, Л. Т. Сомбреро и П. Дж. Рууту (Консорциум ARIVAC). Скоро. «Серьезные детские инфекции, приобретенные в сообществе, в сельских районах Азии (остров Бохол, Филиппины)». Журнал детских инфекционных болезней .
Редд С. Диагностика и лечение острых респираторных инфекций в Лесото. Политика и управление здравоохранением. 1994; 5: 255–60.
- Райли И. Д., Эверингем Ф. А., Смит Д. Э., Дуглас Р. М. Иммунизация поливалентной пневмококковой вакциной: влияние респираторной смертности у детей, живущих в Высокогорье Новой Гвинеи. Архив болезней детства. 1981. 56 (5): 354–57. [Бесплатная статья PMC: PMC1627425] [PubMed: 7020609]
- Райли И. Д., Леманн Д., Альперс М. П. Испытания пневмококковой вакцины в Папуа-Новой Гвинее: взаимосвязь между эпидемиологией пневмококковой инфекции и эффективностью вакцины. Обзоры инфекционных болезней.1991; 13 (Приложение 6): S535–41. [PubMed: 1862283]
- Рудан И., Томаскович Л., Боски-Пинто К., Кэмпбелл Х. Справочная группа ВОЗ по эпидемиологии здоровья детей. Глобальная оценка заболеваемости клинической пневмонией среди детей в возрасте до пяти лет. Бюллетень Всемирной организации здравоохранения. 2004. 82 (12): 895–903. [Бесплатная статья PMC: PMC2623105] [PubMed: 15654403]
Рудан и другие. Скоро.
- Santosham M., Wolff M., Reid R., Hohenboken M., Bateman M., Goepp J.и другие. Эффективность конъюгированной вакцины, состоящей из Haemophilus influenzae типа B и Neisseria meningitidis Внешнемембранного белкового комплекса, у младенцев навахо. Медицинский журнал Новой Англии. 1991. 324 (25): 1767–72. [PubMed: 1
6]
- Сазавал С., Блэк Р. Е. Группа исследований по ведению больных с пневмонией: влияние ведения больных с пневмонией на смертность новорожденных, младенцев и детей дошкольного возраста — метаанализ испытаний на уровне сообществ. Ланцетные инфекционные болезни.2003; 3: 547–56. [PubMed: 12954560]
- Schellenberg J. A., Victora C.G., Mushi A., de Savigny D., Schellenberg D., Mshinda H. et al. Неравенство среди очень бедных: здравоохранение для детей в сельских районах Южной Танзании. Ланцет. 2003. 361 (9357): 561–66. [PubMed: 12598141]
- Шнайдер Г. Обеспечение кислородом в сельских районах Африки: личный опыт. Международный журнал туберкулеза и болезней легких. 2001. 5 (6): 524–26. [PubMed: 11409578]
Шумахер, Р., Э. Сведберг, М.О. Диалло, Д. Р. Кейта, Х. Кальтер, О. Паша. 2002. Исследование смертности в Гвинее: исследование причин смерти детей в возрасте до пяти лет . Арлингтон, Вирджиния: Спасите детей и базовая поддержка для институционализации проекта выживания детей.
- Шэнн Ф. Этиология тяжелой пневмонии у детей в развивающихся странах. Детская инфекционная болезнь. 1986. 5 (2): 247–52. [PubMed: 3952013]
- Шенн Ф., Граттен М., Гермер С., Линнеманн В., Хазлетт Д., Пейн Р. Этиология пневмонии у детей в больнице Горока, Папуа-Новая Гвинея.Ланцет. 1984; 2 (8402): 537–41. [PubMed: 6147602]
- Шэнн Ф., Харт К., Томас Д. Острые инфекции нижних дыхательных путей у детей: возможные критерии отбора пациентов для антибактериальной терапии и госпитализации. Бюллетень Всемирной организации здравоохранения. 1984; 62: 749–51. [Бесплатная статья PMC: PMC2536213] [PubMed: 6334573]
- Simoes E. A. Респираторно-синцитиальная вирусная инфекция. Ланцет. 1999. 354 (9181): 847–52. [PubMed: 10485741]
- Симоэс Э. А., Деста Т., Тессема Т., Gerbresellassie T., Dagnew M., Gove S. Эффективность медицинских работников после обучения комплексному ведению детских болезней в Гондэре, Эфиопия. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 43–53. [Бесплатная статья PMC: PMC2487005] [PubMed: 9529717]
- Слойер Дж. Л. Дж., Плуссард Дж. Х., Хоуи В. М. Эффективность пневмококковой полисахаридной вакцины в предотвращении острого среднего отита у младенцев в Хантсвилле, Алабама. Обзоры инфекционных болезней. 1981; 3 (Прил.): S119–23. [PubMed: 7280444]
- Стенсбаль Л.Г., Девасундарам Дж. К., Симоэс Э. А. Эпидемии респираторно-синцитиального вируса: взлеты и падения сезонного вируса. Журнал детских инфекционных болезней. 2003; 22 (2 доп.): S21–32. [PubMed: 12671449]
- Штраус В. Л., Кази С. А., Кунди З., Номани Н. К., Шварц Б. Группа по изучению ко-тримоксазола. Устойчивость к противомикробным препаратам и клиническая эффективность ко-тримоксазола по сравнению с амоксициллином при пневмонии у детей в Пакистане: рандомизированное контролируемое исследование. Ланцет. 1998. 352: 270–74. [PubMed: 96]
- Темпл К., Гринвуд Б., Инскип Х., Холл А., Коскела М., Лейнонен М. Ответ антител на пневмококковую капсульную полисахаридную вакцину у африканских детей. Журнал детских инфекционных болезней. 1991. 10 (5): 386–90. [PubMed: 2067888]
- Тупаси Т. Э., Лусеро М. Г., Магдангал Д. М., Мангубат Н. В., Сунико М. Э., Торрес К. У. и др. Этиология острой инфекции нижних дыхательных путей у детей из Алабанга, Метро Манила. Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S929–39. [PubMed: 2270415]
ЮНЭЙДС (Объединенная программа Организации Объединенных Наций по ВИЧ / СПИДу).2002. Обновление эпидемии СПИДа . Женева: ЮНЭЙДС.
- Усен С., Вебер М., Малхолланд К., Джаффар С., Опарауго А., Омосиго С. и др. Клинические предикторы гипоксемии у детей Гамбии с острой инфекцией нижних дыхательных путей: проспективное когортное исследование. Британский медицинский журнал. 1999. 318 (7176): 86–91. [Бесплатная статья PMC: PMC27680] [PubMed: 9880280]
- Van den Hoogen BG, de Jong JC, Groen J., Kuiken T., de Groot R., Fouchier RA, Osterhaus AD Недавно обнаруженный человеческий пневмовирус, выделенный у детей раннего возраста при заболевании дыхательных путей.Природная медицина. 2001; 7: 719–24. [Бесплатная статья PMC: PMC7095854] [PubMed: 11385510]
- Вуори-Холопайнен Э., Пелтола Х. Переоценка легочного легочного: обзор старого метода для лучшей этиологической диагностики детской пневмонии. Клинические инфекционные болезни. 2001. 32 (5): 715–26. [PubMed: 11229839]
- Вебер М. В., Малхолланд Э. К., Джаффар С., Трёдссон Х., Гоув С., Гринвуд Б. М. Оценка алгоритма комплексного ведения детских болезней в районе с сезонной малярией в Гамбии.Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 25–32. [Бесплатная статья PMC: PMC2486992] [PubMed: 9529715]
- Венгер Дж. Д., ДиФабио Дж., Ландаверде Дж. М., Левин О. С., Гаафар Т. Внедрение конъюгированных вакцин против Hib в непромышленно развитых странах: опыт в четырех странах, которые «недавно начали принимать» . Вакцина. 1999. 18 (78): 736–42. [PubMed: 10547434]
Wenger, J. D., and M. M. Levine, eds. 1997. Эпидемиологическое влияние конъюгированной вакцины на инвазивное заболевание, вызываемое гемофильной палочкой Haemophilus influenzae Тип B .Нью-Йорк: Марсель Деккер.
- Уитни К. Г., Фарли М. М., Хадлер Дж., Харрисон Л. Х., Беннет Н. М., Линфилд Р. и др. Снижение инвазивного пневмококкового заболевания после введения протеин-полисахаридной конъюгированной вакцины. Медицинский журнал Новой Англии. 2003. 348 (18): 1737–46. [PubMed: 12724479]
ВОЗ (Всемирная организация здравоохранения). 1990. «Антибиотики в лечении острых респираторных инфекций у детей раннего возраста». Неопубликованный документ WHO / ARI / 90.10, доступный по запросу в Отделе здоровья и развития детей, бывшего Отдела борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 1991. «Ведение маленького ребенка с острой респираторной инфекцией. Модуль обучения навыкам супервизии». Неопубликованный документ, доступный по запросу в Отделе здоровья и развития детей ВОЗ, бывшем Отделении борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 2002. Многострановая оценка эффективности, затрат и воздействия ИВБДВ (MCE): отчет о ходе работы, май 2001 г. — апрель 2002 г. .WHO / FCH / CAH / 02.16. Женева: Отдел здоровья и развития детей и подростков, ВОЗ.
———. 2003 г. Консультативное совещание по ведению детей с пневмонией и ВИЧ-инфекцией, 30–31 января 2003 г., Хараре, Зимбабве . WHO / FCH / CAH / 03.4. Женева: ВОЗ.
- ———. 2004a Группа по обзору Haemophilus influenzae Бремя болезни типа B (Hib) в Бангладеш, Индонезия и других азиатских странах, Бангкок, 28–29 января 2004 г. Еженедельный эпидемиологический отчет 79 (18): 173–75.[PubMed: 15168565]
———. 2004b. «Совместное заявление ВОЗ / ЮНИСЕФ: ведение пневмонии в общественных местах». WHO / FCH / CAG / 04.06. ВОЗ, Женева.
ВОЗ (Всемирная организация здравоохранения) и здоровье детей-подростков. Скоро. Отчет о методологии и предположениях, использованных для оценки затрат на расширение отдельных мероприятий по охране здоровья детей до 95% с целью снижения смертности детей в возрасте до пяти лет . Женева: ВОЗ.
- Уильямс Б. Г., Гоус Э., Боски-Пинто К., Брайс Дж., Дай С. Оценки глобального распределения детской смертности от острых респираторных инфекций. Ланцетные инфекционные болезни. 2002; 2: 25–32. [PubMed: 118]
Всемирный банк. 2002. Показатели мирового развития . CD-ROM. Вашингтон, округ Колумбия: Всемирный банк.
- Цви К. Дж., Петтифиор Дж. М., Содерлунд Н. Педиатрическая больница при городской региональной больнице Южной Африки: влияние ВИЧ, 1992–1997. Анналы тропической педиатрии. 1999; 19: 135–42. [PubMed: 106]
Лечение гриппа и ОРВИ у детей препаратом Кагоцел ® — Полный текст
В это неинтервенционное обсервационное исследование были включены 80 пациентов в возрасте от 3 до 11 лет, госпитализированных с гриппом и острыми респираторными вирусными инфекциями (ОРВИ). ) симптомы в любой момент от начала заболевания (до 15 дней) и которым в качестве противовирусного препарата был назначен индуктор интерферона Кагоцел.
Диагноз гриппа и ОРВИ был подтвержден в соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ) по фармакологическому лечению пандемического гриппа A (h2N1) 2009 и других вирусов гриппа.
Все обследования пациентов проводятся в соответствии с местной повседневной клинической практикой и местными и международными стандартами лечения.
После окончания лечения были собраны и проанализированы следующие данные:
- демография
- степень тяжести заболевания
- данных анамнеза (данные о вакцинации против гриппа в текущем сезоне; посещение дошкольных учреждений; предыдущие контакты с больным гриппом / ОРВИ; предыдущая противовирусная терапия при текущем эпизоде заболевания; сопутствующие заболевания)
- температура тела (утро / вечер)
- озноб и лихорадка (совокупная оценка по всем симптомам: 0 — нет симптомов, 1 — легкая, 2 — умеренная, 3 — тяжелая)
- Симптом интоксикации (совокупная оценка по всем симптомам: 0 — нет симптомов, 1 — легкая, 2 — умеренная, 3 — тяжелая)
- катаральных симптомов (совокупный балл по всем симптомам: 0 — нет симптомов, 1 — легкие, 2 — умеренные, 3 — тяжелые)
- сроки: начало заболевания, первый визит к врачу, начало лечения, длительность заболевания
- определение возбудителя методом ПЦР (при поступлении пациентов и их выписке через 5-6 дней от начала терапии)
- противовирусная терапия (доза Кагоцела в зависимости от возраста)
- симптоматическое лечение текущего эпизода гриппа или ОРВИ до и во время госпитализации пациента
- бактериальных обострений (да / нет)
- Лечение бактериальных обострений (название препарата)
- нежелательных явлений
Аденовирусная инфекция у детей | Сидарс-Синай
Не то, что вы ищете?Что такое аденовирусная инфекция у детей?
Аденовирусы — группа вирусов. вызывающие различные инфекции, например:
- Респираторное заболевание, например простуда
- Инфекция глаз (конъюнктивит, также называемый розовым глазом)
- Круп
- Бронхиолит
- Пневмония
У детей аденовирусы чаще всего вызывают инфекции дыхательной системы, но они также вызывают инфекции пищеварительного тракта.Респираторные инфекции чаще всего встречаются в конце зимы, весной и в начале лета. Но эти инфекции могут возникать в любое время в течение года.
Что вызывает аденовирусную инфекцию у ребенка?
Инфекция вызывается одним из аденовирусов группы. Это наиболее распространенные способы передачи вирусов от ребенка к ребенку:
- Респираторная инфекция. Жидкость из носа, рта, горла и легких (дыхательные пути) может содержать вирус.Респираторные инфекции распространяются, когда зараженный вирус кашляет или чихает другому человеку. Он также может распространяться при прикосновении к объекту, зараженному вирусом. Вирус может жить много часов на дверных ручках, прилавках и игрушках.
- Инфекция пищеварительного тракта. Эта форма вируса передается фекально-оральным путем. Часто это происходит из-за того, что ребенок мыл руки недостаточно или должным образом. Это также может быть вызвано употреблением в пищу или питье зараженной пищи или воды.
Какие дети подвержены риску аденовирусных инфекций?
Аденовирусная инфекция может возникнуть у ребенка любого возраста. Дети в возрасте от 6 месяцев до 2 лет, которые находятся в детских учреждениях, чаще заболевают этими вирусами. Аденовирусные инфекции пищеварительного тракта чаще встречаются у детей в возрасте до 5 лет. Большинство детей перенесли хотя бы одну аденовирусную инфекцию к 10 годам.
Каковы симптомы аденовирусной инфекции у ребенка?
Большинство аденовирусных инфекций протекают в легкой форме с небольшими симптомами.Но симптомы могут проявляться у каждого ребенка по-разному. Ниже перечислены наиболее частые симптомы аденовирусных инфекций.
Симптомы респираторных инфекций могут проявиться через 2–14 дней после контакта. Они могут включать:
- Насморк
- Боль в горле
- Лихорадка
- Сильный кашель
- Увеличение лимфатических узлов
- Головная боль
- Розовый глаз
Симптомы инфекции пищеварительного тракта могут проявиться через 3–10 дней после заражения.Симптомы обычно возникают у детей младше 5 лет и могут длиться от 1 до 2 недель. Они могут включать:
- Водянистая диарея, которая начинается внезапно
- Лихорадка
- Боль в животе
- Рвота
Симптомы аденовирусной инфекции могут быть такими же, как и при других состояниях здоровья. Убедитесь, что ваш ребенок посещает своего врача для постановки диагноза.
Как диагностируют аденовирусные инфекции у ребенка?
Медицинский работник спросит о симптомах и истории здоровья вашего ребенка.Он или она проведет медицинский осмотр вашего ребенка. Тесты на аденовирус нужны только очень больным детям или детям с другими серьезными проблемами со здоровьем. Тесты могут включать:
- Анализы крови
- Мазок из глаз, носа или горла для исследования
- Образцы стула
- Рентген грудной клетки
Как лечат аденовирусные инфекции у ребенка?
Лечение будет зависеть от симптомов, возраста и общего состояния вашего ребенка.Это также будет зависеть от степени тяжести состояния.
Лечение аденовирусных инфекций помогает облегчить симптомы. Антибиотики , а не , используются для лечения аденовирусов.
Лечение респираторной инфекции может включать:
- Еще жидкости. Очень важно следить за тем, чтобы ваш ребенок пил много жидкости. При необходимости вашему ребенку будет введен внутривенный (IV) провод для введения жидкости и электролитов.
- Бронходилатирующие препараты. Их можно использовать для открытия дыхательных путей вашего ребенка. Их часто вводят в виде аэрозольного тумана через маску или через ингалятор.
- Дополнительный кислород. Это дополнительный кислород, поступающий через маску, носовые канюли или кислородную палатку.
- Механическая вентиляция. Сильно больному ребенку может понадобиться подключить дыхательный аппарат (вентилятор), чтобы помочь ему дышать.
Лечение пищеварительной инфекции может включать:
- Пероральная регидратация. Пероральная регидратация водой, молочной смесью, грудным молоком или специальными жидкостями, содержащими электролиты, очень важна. Электролитические жидкости содержат сбалансированное количество сахаров и солей. Не используйте газированные напитки, соки или спортивные напитки для регидратации очень маленьких детей.
- Переносимость твердой пищи. Спросите у врача, какие продукты лучше.
Ребенку с сильной потерей воды (обезвоживанием) может потребоваться лечение в больнице. Это обращение может включать:
- IV жидкости. Это жидкость, вводимая через тонкую гибкую трубку в вену.
- Питания через трубку. Через нос в желудок ребенка вводится небольшая трубка, чтобы можно было давать смеси или жидкости.
- Анализы крови. Это делается для измерения уровня сахара, соли и других химических веществ (электролитов) в крови вашего ребенка.
Обсудите с лечащим врачом вашего ребенка риски, преимущества и возможные побочные эффекты всех лекарств.
Какие возможные осложнения аденовирусной инфекции у ребенка?
Возможные осложнения включают:
- Хроническая болезнь легких. В очень редких случаях у ребенка, заболевшего пневмонией от аденовируса, может развиться хроническое заболевание легких.
- Тяжелая инфекция. Ребенок со слабой иммунной системой подвергается риску более серьезного заражения аденовирусами.
- Инвагинация. Это когда одна часть кишечника скользит по другой части, как телескоп. Это вызывает непроходимость кишечника. Чаще всего встречается у младенцев.Это неотложная медицинская помощь. Симптомы могут включать кровавый стул, рвоту, вздутие живота, согнутые колени к груди, громкие крики от боли, слабость и недостаток энергии.
Как я могу помочь предотвратить заражение аденовирусом моего ребенка?
Для предотвращения распространения аденовирусов среди других людей:
- Мойте руки до и после ухода за ребенком. Используйте теплую воду с мылом и потрите не менее 20 секунд.Хорошо промойте и высушите на воздухе или используйте чистое полотенце.
- Убедитесь, что ваш ребенок часто моет руки, особенно перед едой и после посещения туалета.
- Попросите ребенка прикрыть рот и нос во время чихания или кашля.
- Помогите своему ребенку избежать тесного контакта с больным человеком.
- Убедитесь, что ваш детский центр поощряет мытье рук.
Если ваш ребенок находится в больнице, медицинские работники могут носить специальную изоляционную одежду при входе в палату вашего ребенка.Это могут быть больничные халаты, перчатки и маски.
Когда мне следует позвонить поставщику медицинских услуг для моего ребенка?
Позвоните поставщику медицинских услуг, если у вашего ребенка:
- Симптомы, которые не проходят или не ухудшаются
- Новые симптомы
Основные сведения об аденовирусных инфекциях у детей
- Аденовирусы — это группа вирусов, вызывающих различные заболевания.У детей аденовирусы чаще всего вызывают инфекции дыхательной системы и пищеварительного тракта.
- Аденовирусная инфекция может возникнуть у ребенка любого возраста. Большинство детей к 10 годам перенесли хотя бы одну аденовирусную инфекцию.
- Большинство аденовирусных инфекций протекает в легкой форме с небольшими симптомами. Симптомы могут включать насморк, боль в горле, жар и кашель. Или же они могут включать водянистый понос, лихорадку и боль в животе.
- Лечение проводится для облегчения симптомов.Антибиотики не используются для лечения аденовирусов.
- Мытье рук — лучший способ предотвратить распространение аденовирусов среди других.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от посещения лечащего врача вашего ребенка:
- Знайте причину визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции, которые ваш поставщик дает вам для вашего ребенка.
- Узнайте, почему прописано новое лекарство или лечение и как они помогут вашему ребенку. Также знайте, какие бывают побочные эффекты.
- Спросите, можно ли вылечить состояние вашего ребенка другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если ваш ребенок не принимает лекарство, не проходит обследование или процедуру.
- Если вашему ребенку назначен повторный прием, запишите дату, время и цель этого визита.
- Узнайте, как можно связаться с лечащим врачом вашего ребенка в нерабочее время. Это важно, если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.
Лечение ОРВИ у детей в Киеве
Простуда — самая частая причина недуга ребенка и обращения к педиатрам.Простуда может быть вызвана сотнями вирусов, вызывающих аналогичные симптомы; поэтому при обращении с ней пациенты ставят диагноз «Острая респираторная вирусная инфекция» — острая респираторная вирусная инфекция.
СИМПТОМЫ ОРВИВ группу ОРВИ входят более двух сотен различных вирусов, которые проявляются практически одинаковыми симптомами:
- насморк, чихание;
- кашель;
- боль в горле, его покраснение;
- озноб, боль в суставах, мышечная боль;
- головная боль, слабость, вялость;
- увеличение лимфатических узлов;
- повышенная температура;
- жжение и боль в глазах.
Комплекс симптомов и их выраженность могут как-то различаться в зависимости от того, какая инфекция поразила ребенка (аденовирус, ревовирус, риновирус и др.), И от состояния его иммунитета.
ПРИЧИНЫ ОРВИЕдинственная причина развития болезни — заражение одним из вирусов, входящих в широкую группу ОРВИ, от уже инфицированного ребенка или взрослого. Вирус выделяется при кашле или чихании и передается через поцелуи, совместное пользование посудой и средствами личной гигиены, находясь в комнате с больным человеком.
Заболевание имеет ярко выраженный сезонный характер, поражая детей преимущественно в осенне-зимний период. Ребенок очень часто заболевает, начиная ходить в детский сад или школу, где тесно контактирует с другими детьми, в том числе с инфицированными.
Возможны ситуации, когда ребенок, только что пережив простуду, снова заражается. Это связано с тем, что у ребенка, перенесшего ОРВИ, вырабатывается кратковременный иммунитет, но только против конкретного вируса, а не всей группы ОРВИ.Рецидивирующее заболевание может быть вызвано другим вирусом, но схожесть симптомов не позволяет его определить.
В большинстве случаев организм самостоятельно справляется с ОРВИ за 5-7 дней. В этом случае задача педиатра — назначить лечение, которое позволит уменьшить неприятные симптомы и следить за тем, чтобы не возникли осложнения.
Дополнительная диагностика, определяющая, какой именно вирус поразила организм ребенка, обычно не проводится.Это связано с тем, что организм быстро нейтрализует вирус самостоятельно, без применения антивирусной терапии. К тому же анализы и обследования занимают какое-то время (до нескольких дней), а когда анализы готовы, организм уже справляется с инфекцией.
Только в том случае, если болезнь протекает тяжело и длительно, а ребенок регулярно болеет, целесообразно провести дополнительные обследования.
Симптоматическое лечение, назначенное врачом, может включать жаропонижающие и противовоспалительные препараты, препараты для облегчения боли в горле, ингаляции, кварцевые тубусы и т. Д.
Самолечение ОРВИ без помощи педиатра не рекомендуется, так как родители не всегда распознают ранние признаки возможных осложнений.
Вы можете записаться на прием к педиатру, позвонив нам или заполнив форму обратной связи на нашем сайте.
.


 Дозы и курс лечения согласовать с врачом.
Дозы и курс лечения согласовать с врачом. Суточный объем жидкости для детей раннего возраста должен составлять на период лихорадки 150 мл на 1 кг веса, после снижения температуры – 100 мл.
Суточный объем жидкости для детей раннего возраста должен составлять на период лихорадки 150 мл на 1 кг веса, после снижения температуры – 100 мл.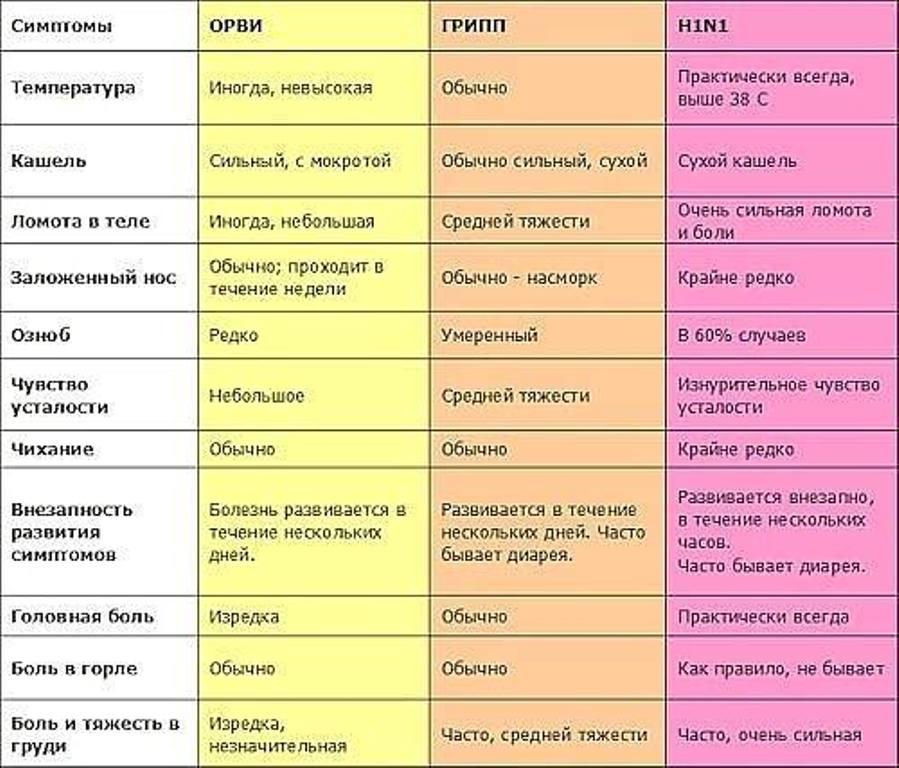 Можно истолченный чеснок настоять на молоке — 2 — 3 дольки на полстакана молока. И даже детям до года можно в таком виде давать по каплям. «Чесночное» масло: измельченный чеснок смешать со сливочным маслом и использовать для бутербродов. Очищенный чеснок можно повесить в марлевом мешочке над кроватью или положить под подушку.
Можно истолченный чеснок настоять на молоке — 2 — 3 дольки на полстакана молока. И даже детям до года можно в таком виде давать по каплям. «Чесночное» масло: измельченный чеснок смешать со сливочным маслом и использовать для бутербродов. Очищенный чеснок можно повесить в марлевом мешочке над кроватью или положить под подушку.

 Детям младше 1 года назначают суппозитории «Виферон», «Генферон», «Кипферон» и капли «Гриппферон», которые входят в подгруппу природных и рекомбинантных препаратов интерферона. Синтетические производные интерферона имеют ограничения по возрасту. К примеру, Кагоцел и Полиоксидоний нельзя давать малышам до 3-х лет;
Детям младше 1 года назначают суппозитории «Виферон», «Генферон», «Кипферон» и капли «Гриппферон», которые входят в подгруппу природных и рекомбинантных препаратов интерферона. Синтетические производные интерферона имеют ограничения по возрасту. К примеру, Кагоцел и Полиоксидоний нельзя давать малышам до 3-х лет;
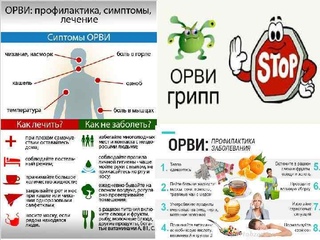
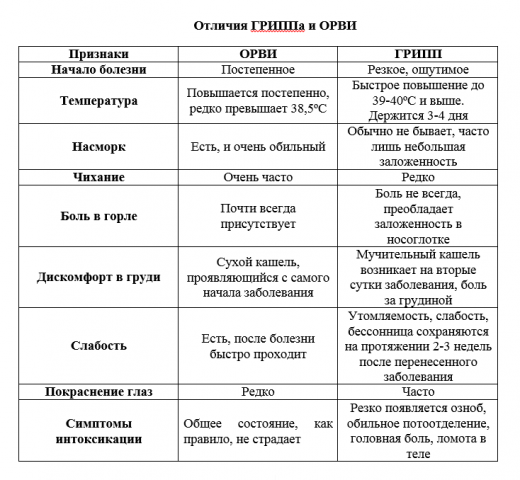
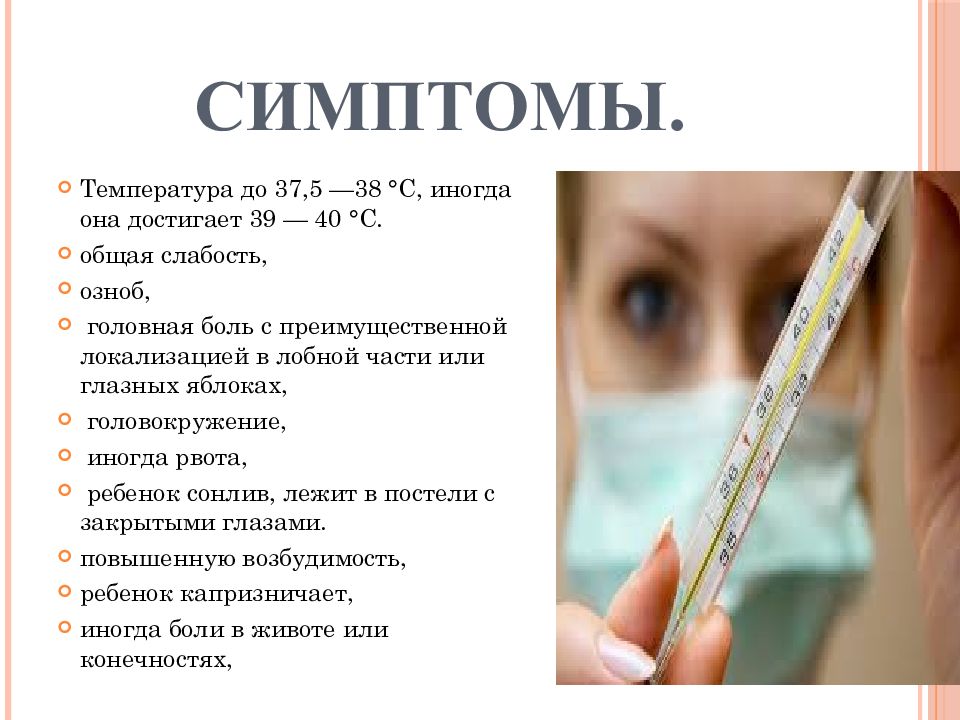

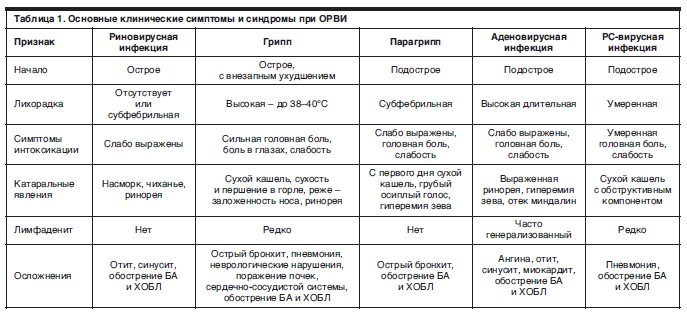

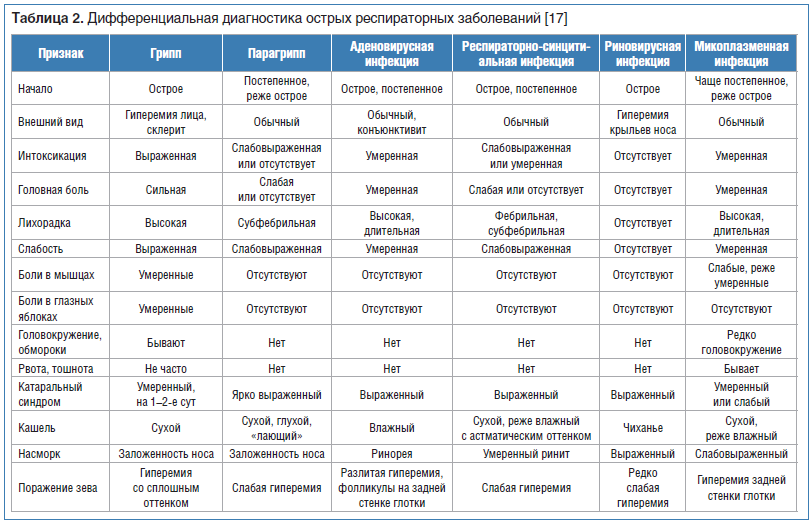

 Однако у взрослых это заболевание может проходить и без симптомов. Диагностируют его по анализу мочи, показывающему повышенное содержание лейкоцитов.
Однако у взрослых это заболевание может проходить и без симптомов. Диагностируют его по анализу мочи, показывающему повышенное содержание лейкоцитов.
 В квартирах с централизованным отоплением этот показатель порой снижается до 15–20 %, что приводит к пересыханию слизистой. С этой же целью рекомендуется промывать нос изотоническим (0,9%-м) солевым раствором, а также полоскать горло, поскольку соль обладает свойством удерживать влагу.
В квартирах с централизованным отоплением этот показатель порой снижается до 15–20 %, что приводит к пересыханию слизистой. С этой же целью рекомендуется промывать нос изотоническим (0,9%-м) солевым раствором, а также полоскать горло, поскольку соль обладает свойством удерживать влагу.
 Хотя сами по себе эти растения очень полезны, поскольку содержат фитонциды.
Хотя сами по себе эти растения очень полезны, поскольку содержат фитонциды. В школах для этого вполне разумно вводят карантин.
В школах для этого вполне разумно вводят карантин. В городских квартирах в отопительный период врачи рекомендуют использовать увлажнители, чтобы повысить ее как минимум до 60 %, особенно в детской комнате.
В городских квартирах в отопительный период врачи рекомендуют использовать увлажнители, чтобы повысить ее как минимум до 60 %, особенно в детской комнате.